(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义。为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-。电池工作时正极反应式为 。
若以该电池为电源,用石墨做电极电解100 mL含有如下离子的溶液。
| 离子 |
Cu2+ |
H+ |
Cl- |
 |
| c/mol·L-1 |
1 |
4 |
4 |
1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为 L。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为 ,该过程中被氧化的元素是 ,当产生标准状况下2.24 L CO2时,共转移电子 mol。
氯离子插层镁铝水滑石
是一种新型离子交换材料,其在高温下完全分解为
、
、
和水蒸气.现用如图装置进行实验确定其化学式(固定装置略去).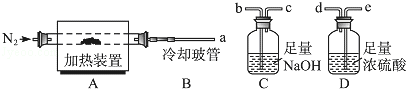
(1)
热分解的化学方程式为.
(2)若只通过测定装置
、
的增重来确定x,则装置的连接顺序为(按气流方向,用接口字母表示),其中
的作用是.装置连接后,首先要进行的操作的名称是.
(3)加热前先通
排尽装置中的空气,称取
、
的初始质量后,再持续通入
的作用是、等.
(4)完全分解后测得C增重3.65
、
增重9.90
,则
=.若取消冷却玻管
后进行实验,测定的
值将(填"偏高"或"偏低").
(5)上述水滑石在空气中放置时易发生反应生成
,该生成物能发生类似的热分解反应.现以此物质为样品,用(2)中连接的装置和试剂进行实验测定
,除测定
的增重外,至少还需测定.
金刚石、
具有优良的耐磨、耐腐蚀特性,应用广泛.
(1)碳与短周期元素
的单质化合仅能生成两种常见气态化合物,其中一种化合物
为非极性分子.碳元素在周期表中的位置是,
是,
的电子式为.
(2)一定条件下,
还原
可制备金刚石,反应结束冷却至室温后,回收其中的
的实验操作名称为,除去粗产品中少量钠的试剂为.
(3)碳还原
制
,其粗产品中杂质为
和
.现将20.0
粗产品加入到过量的
溶液中充分反应,收集到0.1
氢气,过滤得
固体11.4
,滤液稀释到1
.生成氢气的离子方程式为,硅酸盐的物质的量浓度为.
(4)下列叙述正确的有(填序号).
①
还原
的反应、与
的反应均是置换反应
②水晶、干冰熔化时克服粒子间作用力的类型相同
③
溶液与
的反应可用于推断
与
的非金属性强弱
④钠、锂分别在空气中燃烧,生成的氧化物中阴阳离子数目比均为1:2.
[化学﹣有机化学基础]
合成
(一种抗氧化剂)的路线如下:
已知:① (
为烷基);
(
为烷基);
②
和F互为同分异构体,
分子中有三个甲基,
分子中只有一个甲基.
(1)
→B的反应类型为.
经催化加氢生成
(
),
的化学名称是.
(2)
与浓HBr溶液一起共热生成H,H的结构简式为.
(3)实验室中检验
可选择下列试剂中的.
a.盐酸 b.
溶液
c.
溶液 d.浓溴水
(4)
与足量
溶液反应的化学反应方程式为(有机物用结构简式表示).
金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)
是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是.
(3)过滤金属配合物
的中心原子价电子数与配体提供电子总数之和为18,则
.
与
结构相似,
分子内
键与
键个数之比为.
(4)甲醛(
)在
催化作用下加氢可得甲醇(
).甲醇分子内
原子的杂化方式为,甲醇分子内的
键角(填"大于""等于"或"小于")甲醛分子内的
键角.
石油和煤炭加工过程涉及多种技术和设备.
(1)石油分馏时,在不断向(填工业设备名称)内投放原料的同时获得产品,该过程为操作过程.
(2)石油裂化分为热裂化、和加氢裂化,裂化的目的是提高的产量.
(3)煤的洗选是为了降低原煤中灰分和的含量.煤的流化床燃烧是指空气从底部吹向煤炭颗粒,并使全部煤炭颗粒进行燃烧的过程.
(4)煤的直接液化是煤与适当溶剂混合后在高温和存在下与作用生成液体燃料的过程.