铜族元素包括Cu、Ag、Au,其单质均为面心立方晶体。
(1)基态Au原子有 个未成对电子,Cu2+的电子排布式为 ,向Cu2+溶液中加入足量的氨水后,再加入无水乙醇,可析出一种配合物,其中N原子的杂化轨道类型为______________,该配合物的颜色为 。
(2)Cu2O是一种共价型化合物,其立方晶胞内:氧原子分别位于立方体的顶点和体心,则该晶胞中有个铜原子,其中氧原子的配位数为 。
(3)钇钡铜氧超导体的理想晶胞如图所示,其化学式为: ,该晶体中Y为+3,Ba为+2,铜为+2、+3,则铜元素中+2价铜的百分含量为 ;Y的价电子排布式为4d15s2,则Y在周期表的位置: ,
(4)已知Ag的晶胞参数a=0.408 nm,列式表示Ag单质的密度_________g·cm-3(不必计算出结果)。
在下列①NH3、②NH4Cl、③金刚石、④KBr、⑤甲烷、⑥CO2、⑦Ar七种物质中,请用编号填空:其中只含有离子键的是,只含有共价键且为直线型分子的是,空间构型为正四面体结构的分子是,熔点最高的是,不存在化学键的物质是。
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。
(1)图中属于烷烃的是(填字母)。
(2)在上图的有机化合物中,碳原子与碳原子之间不仅可以形成共价单键,还可以形成和;不仅可以形成,还可以形成碳环。
(3)上图中互为同分异构体的是:A与;B与;D与。(填字母)
Ⅰ.用导线将A、B两装置的四个电极进行连接,使a极析出铜。回答有关问题。
(1)导线将容器A和B连接时,Zn接,Cu接(填“a”或“b”)
(2)容器A中Cu极发生的电极反应为。
(3)B装置叫,溶液中的NO3-向_____极移动(填“a”或“b”)。
(4)若b极观察到有无色无味气泡产生, 经过一段时间后,停止反应并搅拌均匀,溶液的pH值将(填“升高”、“降低”或“不变”),加入一定量的后(填化学式),溶液能恢复至与反应前完全一致。若反应一段时间后,测得溶液中Cu2+浓度没有明显下降,可能的原因是:。
Ⅱ.炒菜的铁锅没有洗干净容易生锈。用必要的文字和有关化学方程式说明铁锈是如何形成的
。
高铁酸钾(K2FeO4)具有极强的氧化性,是一种优良的水处理剂。
(1)FeO42-与水反应的方程式为:4FeO42- + 10H2O  4Fe(OH)3 + 8OH-+ 3O2,
4Fe(OH)3 + 8OH-+ 3O2,
K2FeO4在处理水的过程中所起的作用是和。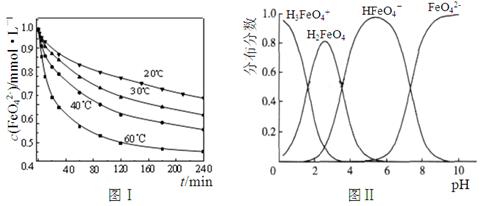
(2)将适量K2FeO4配制成c(FeO42-) =1.0×10-3 mol·L-1(1.0mmol·L-1)的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO42-)的变化,结果见图Ⅰ。题(1)中的反应为FeO42-变化的主反应,该反应的△H0。
(3)FeO42-在水溶液中的存在形态如图Ⅱ所示。下列说法正确的是(填字母)。
A.不论溶液酸碱性如何变化,铁元素都有4种存在形态
B.改变溶液的pH,当溶液由pH=10降至pH=4的过程中,HFeO4-的分布分数先增大后减小
C.向pH=8的这种溶液中加KOH溶液,发生反应的离子方程式为:H2FeO4+OH-=HFeO4-+H2O
D.pH约为2.5 时,溶液中H3FeO4+和HFeO4-比例相当
(4)HFeO4- H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近(填字母)。
H++FeO42-的电离平衡常数表达式为K=___________________,其数值接近(填字母)。
A.10-2.5B.10-6C.10-7D.10-10
(5)25℃时,CaFeO4的Ksp = 4.536×10-9,若要使100mL,1.0×10-3 mol·L-1的K2FeO4溶液中的c(FeO42- )完全沉淀,理论上至少要加入的Ca(OH)2的物质的量为mol,
完全沉淀后溶液中残留的c(FeO42- )为______________。
在2.00L的密闭容器中,反应2A(g) B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
B(g)+ C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L。反应物A的浓度随时间的变化如下图所示:
请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是:(填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=" 2" v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为,
B平均反应速率为。
(3)与①比较,②和③分别仅改变一种反应条件。所改变的条件是:
②;③。
(4)实验①条件下该反应的化学平衡常数值是。若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028mol B和0.028mol C,求新平衡时体系中A的物质的量浓度。(写出计算过程)