(1)在配合物[Zn(NH3)4]2+中,提供空轨道的微粒是___________,在配合物物质[Co(NH3)5Cl]Cl2 中,配位数数值是_________(填数字)。
(2)根据价电子对互斥理论预测HCN的空间结构为 形,其中C原子用于形成σ键的是2个sp杂化轨道。(提示:HCN分子中所有原子的最外电子都达稳定结构。)
(3)在NaCl晶体中任一个Na+与它最近且等距离的Cl-有______个。
某硫酸厂周围的空气含有较多二氧化硫,为了测定空气中二氧化硫的体积分数做了如下实验:
取上述标准状况下的空气1L(内含N2、O2、SO2、CO2)慢慢通过足量氯水,然后在此溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗净、干燥后称重为0.466g。
(1)此空气中SO2的体积分数为多少(写清楚具体的计算过程)
(2)若将上述标准状况下的空气1L慢慢通过足量硫化氢水溶液,将析出沉淀的质量是多少?
某烃0.2mol完全燃烧后生成CO2为17.92L(标准状况),生成水18g。则此烃的化学式为;该烃可能有的结构简式为。
(6分)石油通过裂化和裂解可以得到乙烯,乙烯的产量可以用来衡量一个国家石油化工发展水平。下图是由乙烯为原料生产某些化工产品的转化关系图。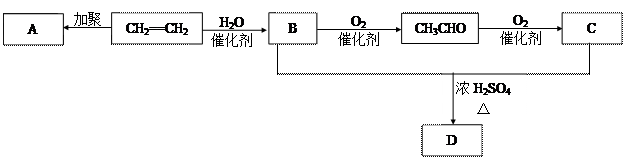
据此回答下列问题。
(1)写出乙烯的一种用途_______,指出乙烯→B的反应类型(选填取代反应或加成反应)。
(2)写出A的结构简式__________________。
(3)写出B + C → D的化学反应方程式___________________________________。
电解原理在化学工业中广泛的应用。如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: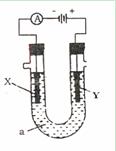
(1)若X、Y都是惰性电极,a是饱和CuSO4溶液,实验开始时,同时在两边各滴入石蕊试液,则①Y电极上的电极反应式为
②在Y电极附近观察到的现象是
(2)若X、Y都是铜电极,a是浓度均为2mol·L-1的AgNO3与Cu(NO3)2的混合溶液1L,电解一段时间后X电极上有12.8g铜析出,此时直流电源已输出mol电子。
(3)用石墨电极电解100mLH2SO4和CuSO4混合液,通电一段时间后,两极各出现气体3.36L(标准状况),求原来溶液中CuSO4的浓度。
请用学过的知识分析其中的化学原理并写出化学方程式,属于离子反应的请写出离子方程式。(1)将氯气通入熟石灰即可制的漂白粉【漂白粉的有效成分是次氯酸钙Ca(ClO)2,商品漂白粉往往含有Ca(OH)2等杂质】。(2)漂白粉之所以具有漂白作用是由于Ca(ClO)2在水溶液中发生水解反应生成具有强氧化性的物质。(3)Ca(OH)2杂质的存在使溶液的碱性增强,因此漂白作用进行缓慢。要在短时间受到漂白效果,必须除去Ca(OH)2,所以工业上使用漂白粉是常加入少量弱酸如醋酸等,或加入少量的稀盐酸、
。(4)家庭使用漂白粉不必加酸,因为水中的CO2也起到了弱酸的作用。(5)不要将漂白粉与洁厕剂等强酸性物质混合使用,因为在强酸性条件下二者可以发生氧化还原反应生成一种有毒气体: