下列离子方程式中,正确的
| A.向AlCl3溶液中逐渐滴入NaOH溶液至过量:Al3++4OH-=AlO2-+2H2O |
| B.将碳酸钙加入过量盐酸中:CO32-+2H+=CO2↑+H2O |
| C.向氯化铁溶液中加入铁粉:2Fe3++Fe=3Fe2+ |
| D.在CuSO4溶液中加入Ba(OH)2溶液:Ba2+ + SO42-= BaSO4↓ |
常温下,用 0.2mol•L-1HCl溶液滴定10mL浓度为0.2mol•L-1 Na2CO3溶液,所得滴定曲线如图所示。下列说法不正确的是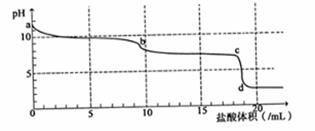
| A.a点时:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-) |
| B.当盐酸加入5mL时:c(CO32-)+c(HCO3-)+c(H2CO3)=2c(Cl-) |
| C.当盐酸加入10mL时:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| D.b-c段发生的反应为:HCO3-+H+= CO2↑+H2O |
为了探索外界条件对反应2NO2(g) N2O4(g) ΔH=- 57 kJ·mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如下图所示。下列说法正确的是
N2O4(g) ΔH=- 57 kJ·mol-1的影响,若保持气体总质量不变,在温度为T1、T2时,通过实验得到平衡体系中NO2的体积分数随压强变化曲线,实验结果如下图所示。下列说法正确的是
| A.a、c两点气体的平均相对分子质量:a>c |
| B.a、c两点气体的颜色:a浅,c深 |
| C.b、c两点的平衡常数:Kb=Kc |
| D.状态a通过升高温度可变成状态b |
利用如图所示装置进行下列实验,下表中对应叙述正确的是
| A |
X为硫酸氢钠,Y为石墨 K与M连接时;K与N连接时 |
一段时间后溶液的pH均增大 |
| B |
X为氯化钠,Y为石墨 K与M连接时; K与N连接时 |
石墨电极反应均为: 4OH--4e-===2H2O+O2↑ |
| C |
X为硫酸氢钠,Y为锌 K与M连接时; K与N连接时 |
铁电极反应均为: 2H++2e-===H2↑ |
| D |
X为氯化钠,Y为锌 K与M连接时; K与N连接时 |
铁电极的保护方法均为: 牺牲阳极的阴极保护法 |
下列对各组离子或物质是否能够大量共存的判断及解释一定正确的是
| A |
25℃时,由水电离出来的c(H+)和c(OH-)的乘积为1×10-24的某溶液中: Fe2+、NO3-、AlO2-、Na+ |
不能共存 |
发生反应: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B |
澄清石灰水中: Cu2+、K+、CH3COO-、HCO3- |
不能共存 |
发生反应: Ca2++OH-+HCO3-= CaCO3↓+H2O |
| C |
常温常压下,空气中: NH3、NO、H2、CO2 |
可以共存 |
不能发生反应 |
| D |
银氨溶液中: K+、Na+、NO3-、Cl- |
可以共存 |
不能发生反应 |
利用如下图所示装置进行下列实验,能得出相应实验结论的是
| 选项 |
① |
② |
③ |
实验结论 |
| A |
稀硫酸 |
Na2CO3 |
Na2SiO3溶液 |
非金属性:S>C>Si |
| B |
稀硝酸 |
Na2S |
AgNO3与AgCl的浊液 |
Ksp(AgCl)>Ksp(Ag2S) |
| C |
浓盐酸 |
MnO2 |
NaOH溶液 |
氧化性:MnO2 >Cl2 |
| D |
浓硫酸 |
蔗糖 |
酸性KMnO4溶液 |
浓硫酸具有酸性、脱水性 |