氢气是一种新型的绿色能源,又是一种重要的化工原料。
(1)氢气的燃烧热值高,H2(g) +1/2 O2(g) = H2O (g) △H =" -241.8" kJ·mol-1
| 化学键 |
H-H |
O=O |
O-H |
| 键能(kJ·mol-1) |
X |
496.4 |
463 |
请根据相关数据计算:H-H的键能X = ________kJ·mol-1。
(2)根据现代工业技术可以用H和CO反应来生产燃料甲醇,其反应方程式如下:
CO2(g) + H2(g) = H2O + CH3OH(g) △H =" -49.00" kJ·mol-1
一定温度下,在体积为1 L的密闭容器中充入1.00 mol CO2和3.00 mol H2,测得CO2和CH3OH的浓度随时间变化如图所示。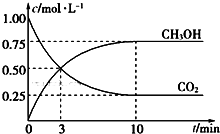
①能说明该反应已达平衡状态的是________(填代号)。
A.CO2在混合气体中的体积分数保持不变
B.单位时间内每消耗1.2 mol H2,同时生成0.4 mol H2O
C.混合气体平均相对分子质量不随时间的变化而变化
D.反应中H2O与CH3OH的物质的量浓度比为1:1,且保持不变
②从反应开始到平衡的平均反应速率v(H2) = ________,达到平衡时氢气的转化率为________。
③该温度下的平衡常数为________(小数点后保留2位)。
④下列的条件一定能加快反应速率并且提高H2转化率的是________(填代号)。
A.升高反应温度
B.缩小容器的体积
C.保持容器体积不变,充入稀有气体
D.保持容器体积不变,充入CO2气体
(1)将100克质量分数为10%的NaOH溶液与50克质量分数为20%的NaOH溶液混合后,加水稀释至溶液体积为500ml,则稀释后NaOH的物质的量浓度为
(2)有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+ 完全沉淀;另一份滴加AgNO3溶液,使Cl— 完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为mol·L-1
(3)某化合物质X,受热分解3X=A+2B+3C,产物均为气体,测得生成物混合气体对相同条件下氢气的相对密度为22 ,则X的相对原子质量为
(4)标准状况下,将15 LO2通入10LH2和CO的混合气中,充分燃烧干燥后,恢复至标准状况
①若剩余的气体体积为15 L,则原混合气中V(CO)=
②若剩余的气体体积为a L,则原混合气中V(CO) : V(H2)=
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32―、Cl一、SO42―,为确认溶液的组成,现取100 mL分成三等份溶液进行如下实验:
(1)向第一份溶液中加入 AgNO3溶液有沉淀产生;
(2)向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58 g,同时收集到气体0.03 mol(设气体全部从溶液中逸出);
(3)向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组成的正确结论是()
| A.溶液中SO42―的浓度是0. 3 mol/L | B.溶液中一定含有A13+和NH4+ |
| C.一定不存在Mg2+,可能存在A13+ | D.一定存在Cl一 可能含CO32— |
氨是最重要的氮肥,是产量最大的化工品之一。德国人哈伯在1905年发明了合成氨的方法,其合成原理为:N2(g)+3H2(g) 2NH3(g)ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g)
2NH3(g)ΔH=-92.4KJ/mol.他因此获得了1918年诺贝尔化学奖。在密闭容器中,使2molN2和6molH2混合发生下列反应:N2(g)+3H2(g) 2NH3(g)(正反应为放热反应)
2NH3(g)(正反应为放热反应)
(1)当反应达到平衡时, N2和H2的转化率比是 。
(2)升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量 ,密度 。(填“变大”“变小”或“不变”)
(3)当达到平衡时,充入氩气,并保持压强不变,平衡将 (填“正向”“逆向”或“不”)移动。
(4)若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”“小于”或 “等于”)原来的2倍。
“低碳循环”引起各国的高度重视,已知煤、甲烷等可以与水蒸气反应生成以CO和H2为主的合成气,合成气有广泛应用。试回答下列问题:
(1)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g) Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0。已知在1 100 ℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值(填“增大”、“减小”或“不变”);
②1 100 ℃时测得高炉中,c(CO2)="0.025" mol·L-1,c(CO)="0.1" mol·L-1,则在这种情况下,该反应向进行(填“左”或“右”),判断依据是。
(2)目前工业上也可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)ΔH=-49.0KJ/mol,现向体积为1L的密闭容器中充入1mol CO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g)ΔH=-49.0KJ/mol,现向体积为1L的密闭容器中充入1mol CO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。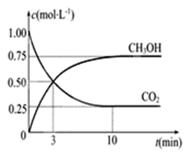
①从反应开始到平衡,氢气的平均反应速率V(H2)=------------。
②反应达到平衡后,下列措施能使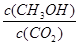 增大的是-------(填符号)
增大的是-------(填符号)
| A.升高温度 | B.再充入H2 | C.再充入CO2 | D.将H2O(g)从体系中分离E.充入He(g) |
在一密闭容器中加入A、B进行可逆反应:A(g) + B(g) mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
mC(g), A的转化率(αA)与温度(T)、压强的关系如下图所示:
(1)此反应的正反应是(放热、吸热)反应
(2)若保持其它条件不变,升高温度,C的产率将(变大、变小);
(3)正反应是体积(缩小、增大)的反应,m值为;
(4)若要提高A的转化率,可采取的措施是:(只写两个)。