(本题共2小题,共18分)Ⅰ.A、B、C、D、E、X是中学常见的无机物,存在下图所示转化关系(部分生成物和反应条件略去);已知A由短周期非金属元素组成,B具有漂白性且光照易分解。
(1)若A为单质,且常温下0.1 mol·L-1C溶液的pH为1,请回答以下问题:
①组成单质A的元素在元素周期表中的位置为 ;
②A与H2O反应的离子反应方程式为 .
③X可能为 (填代号).
a.NaOH b.AlCl3 c.Na2CO3 d.NaAlO2
(2)若A为两种元素形成的化合物,且E与水反应生成G的浓溶液遇C有白烟产生则:
①A的电子式为 .
②A与H2O反应的化学反应方程式为 .
Ⅱ.某化合物A是一种易溶于水的不含结晶水盐,溶于水后可完全电离出三种中学化学常见离子,其中有两种是10电子的阳离子。用A进行如下实验:取2.370gA溶于蒸馏水配成溶液;向该溶液中逐滴加入一定量的氢氧化钠溶液,过程中先观察到产生白色沉淀B,后产生能使湿润红色石蕊试纸变蓝的气体C,气体不再产生时沉淀开始溶解,当沉淀恰好完全溶解时共用去氢氧化钠的物质的量为0.050mol。回答下列问题:
(1)请画出沉淀B中金属元素的原子结构示意图 。
(2)化合物A的化学式为 ;
请设计实验方案验证A中阴离子 ;
(3)请写出沉淀B溶解在氢氧化钠溶液中的离子方程式 .
(4)请写出气体C与氯气发生氧化还原反应的化学方程式 .
(1)某二元酸(化学式用H2B表示)在水中的电离方程式是:H2B═H++HB-、HB- H++B2-回答下列问题:在0。1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
H++B2-回答下列问题:在0。1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=2c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(2)下表为几种酸的电离平衡常数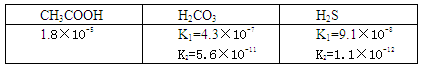
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序,少量CO2与NaHS反应的离子方程式为。
已知下列两个热化学方程式:
H2(g)+  O2(g)====H2O(l) ΔH="-285" kJ·mol-1
O2(g)====H2O(l) ΔH="-285" kJ·mol-1
C3H8(g)+5O2(g)====3CO2(g)+4H2O(l) ΔH="-2" 220.0 kJ·mol-1
(1)实验测得H2和C3H8的混合气体共5 mol,完全燃烧生成液态水时放热6264.5 kJ,则混合气体中H2和C3H8的体积比是__________。
(2)已知H2O(l)====H2O(g) ΔH=+44.0 kJ·mol-1
写出丙烷燃烧生成CO2和气态水的热化学方程式____________________________________________。
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g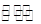 2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
2NO(g)ΔH>0,已知该反应在2 404 ℃时,平衡常数K=64×10-4。
请回答:
(1)某温度下,向2 L的密闭容器中充入N2和O2各1 mol,5分钟后O2的物质的量为0.5 mol,则N2的反应速率________。
(2)假设该反应是在恒容条件下进行,判断该反应达到平衡的标志________。
| A.消耗1 mol N2同时生成1 mol O2 |
| B.混合气体密度不变 |
| C.混合气体平均相对分子质量不变 |
| D.2v(N2)正=v(NO)逆 |
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________(填字母序号)。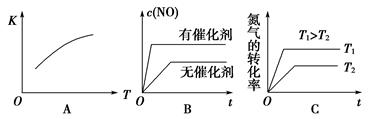
(4)向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数______。(填“变大”、“变小”或“不变”)
(5)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol/L、4.0×10-2mol/L和3.0×10-3 mol/L,此时反应________________________(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是__________________________________________________________。
(20分)物质在水溶液中可能存在电离平衡、盐的水解平衡或沉淀溶解平衡:
(1)有0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中离子浓度由大到小的顺序为。
(2)有0.1 mol·L-1的NaHCO3溶液,在该溶液中存在的平衡有三个,请分别用离子方程式表示:
____________________、__________________________、。
(3)已知25℃时Ksp[Mg(OH)2]=1.2×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,则最先生成的沉淀的离子方程式为
。
(4)NH3·H2O 的电离方程式是,往氨水中加入少量醋酸铵固体(提示醋酸铵呈中性),C(OH-)(填“增大”“减小”“不变”)。
(5)已知某温度下K(NH3·H2O)=1.69×10-5,
则该温度下0.1mol/L的氨水中C(OH-)= mol/L
(6)又已知该温度下Ksp〔Mg(OH)2〕=1.2×10-11,
将0.01mol/L的MgCl2溶液与上述氨水等体积混合(填“有”“无”)沉淀生成。往0.01mol/L的MgCl2溶液中滴加氢氧化钠溶液至pH="10" 此时C(Mg2+)=mol/L。
A、B、C、D、E五种物质都含钠元素,它们按图所示关系相互转化,已知A 为单质。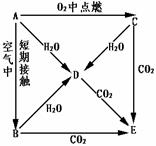
(1)该五种物质中用于焙制糕点的发酵粉及治疗胃酸过多的药品是(填化学式)。
(2)将CO2通入E的饱和溶液中有白色沉淀生成,该反应的离子方程式为。
(3)写出A→D、C→D、C→E反应的化学方程式
A→D:
C→D:
C→E: