食醋中含有醋酸(CH3COOH)。它由 几种元素组成,每个分子共含有 个原子,其相对分子质量是 ,碳元素的质量分数是 ,60g醋酸中含碳元素的质量是 g。
实验室常用块状硫化亚铁(FeS)与稀硫酸在常温下反应制取硫化氢(H2S)。硫化氢性质:①无色、有臭鸡蛋气味的有毒气体,其密度大于空气;②可以燃烧,燃烧时生成水和二氧化硫;③能溶于水,且能与氢氧化钠反应。请根据上述内容和下列装置回答问题(装置用字母表示)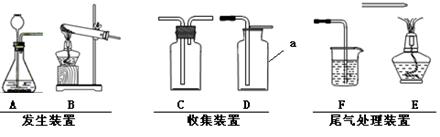
(1)写出装置D中仪器a的名称;
(2)收集硫化氢时应选用的装置,硫化氢尾气处理应选用的装置中装;
(3)A、D组合还能用于实验室制取氧气,方程为:。
(1)根据下列图文回答问题:
①青铜剑属于(填“纯金属”或“合金”)。
②C60分子是由构成的(添“分子”“原子”或“离子”)。
③干冰可用于(填一例)。
(2)根据下图中自制汽水的配料回答问题。
①柠檬酸的pH7(填“<”、“=”或“>”),能使紫色石蕊溶液变为色。
②配料中柠檬酸的主要作用除了调味以外,从化学反应的角度分析,它还有一个重要的作用是;
(3)下列厨房用品所使用的主要材料,属于金属材料的是;
(4)化石燃料在燃烧过程中会产生各种废气(见下图),其中形成酸雨的主要气体是
| A.SO2、CO2 | B.SO2、NO2 | C.CO2、CO | D.NO2、CO |
化学用语是学习化学的关键,请用化学用语填空:
(1)空气中含量最多的气体
(2)地壳中含量最多的金属元素
(3)天然气的主要成分
(4)纯碱
某班同学为验证酸的化学通性,做了五组实验。分析并回答问题。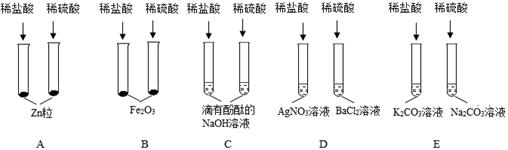
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是_________。
(2)B组试管中实验现象相同,该现象是________________________________。
(3)证明C组物质发生化学反应的现象是_________________________。
(4)上述五组实验中没有体现酸的通性的是______(填序号)。
工业生产的纯碱中常含有少量氯化钠杂质,下列装置是测定纯碱在该混合物中质量分数的实验方法之一。(碱石灰为CaO和NaOH的固体混合物)
①检查装置气密性;
②称量干燥管 I及其干燥剂的总质量为100g;
③将称量好的纯碱样品 12g放入广口瓶 B 中,关闭分液漏斗旋塞;
④在未连接干燥装置之前先通入空气几分钟,然后关闭开关 a,再连接好干燥装置;
⑤从分液漏斗中缓慢加入稀硫酸至不再产生气泡,关闭分液漏斗旋塞:
⑥打开开关a,缓慢鼓入空气几分钟后,再称量干燥管 I的质量为104.4g.
(1)最初鼓入空气的目的是排除装置A、B、C 中的空气,防止测定结果________(填“偏大”、“偏小”)。
(2)装置C的作用是______________。
(3)装置A中一定发生的反应方程式为。
(4)装置B中发生的反应方程式为。
(5)纯碱样品中碳酸钠的质量分数是________(结果精确到0.1%)。