对于铜锌原电池实验后得出的结论和认识中,正确的是
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由铜、锌电极与硫酸铜溶液组成的原电池中铜是负极 |
| C.电子由锌片流经稀硫酸溶液到铜片,氢离子在铜片上得到电子放出氢气 |
| D.铜锌原电池工作时,若有13g锌被溶解,电路中就有0.4mol电子通过 |
下列叙述正确的是
①Na2O和Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2CO3和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀③钠在常温下不容易被氧化④Na2O2可作供氧剂,而Na2O不行⑤Cu与HNO3溶液反应,由于HNO3浓度不同可发生不同的氧化还原反应
| A.②③④⑤ | B.②③⑤ | C.④⑤ | D.都正确 |
用NA表示阿伏加德罗常数的值,下列叙述正确的是:
| A.2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA |
| B.常温下,0.1mol/L HCl溶液中所含的H+个数为0.1NA |
| C.11.2L的CO气体与0.5molN2所含的电子数相等 |
| D.10g H218O中所含的中子数为5NA |
下列实验“操作和现象”与“结论”对应关系正确的是
| 操作和现象 |
结论 |
|
| A |
向用盐酸酸化的FeCl2溶液的试管中加入少量NaNO2溶液,在管口观察到红棕色气体 |
主要原因是: H++NO2-=HNO2, 2HNO2=NO↑+NO2↑+H2O |
| B |
向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成。 |
淀粉没有水解成葡萄糖 |
| C |
向阿司匹林(乙酰水杨酸)中加足量饱和NaHCO3溶液,有大量气泡产生。 |
阿司匹林彻底水解 |
| D |
向1mL1.0mol·L-1AlCl3溶液中滴加2mL10% NH4F溶液,再滴加1mL 3.0mol·L-1NH3·H2O溶液,无沉淀生成。 |
Al3+更易与F-结合成AlF63- |
下列说法或化学方程式正确的是
A.用坩埚灼烧MgCl2·6H2O的反应式:MgCl2·6H2O MgCl2+6H2O MgCl2+6H2O |
| B.在0.1mol?L-1 Na2SO3溶液中:c(Na+)=2c(SO32―)+ c(HSO3―)+ c(H2SO3) |
| C.常温下,将PH=2的稀硫酸稀释10倍,其中各离子的浓度都变为原来的十分之一 |
| D.蛋白质肽链中-NH-上的氢原子与羰基上的氧原子形成氢键是蛋白质二级结构的主要依据 |
维生素A1、B2的结构简式分别如图所示: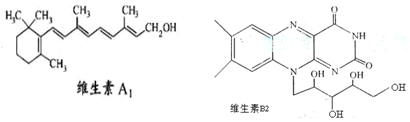
已知: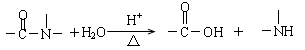
下列说法正确的是
| A.1mol维生素A1最多与溴水中的4molBr2发生加成反应 |
| B.维生素A1的分子式为C19H30O,是一种易溶于水的高分子。 |
| C.维生素B2在酸性条件下彻底水解后得到的有机物,其分子内发生酯化得多种酯 |
| D.用-C4H9取代维生素B2苯环上的一个H原子,最多可得4种同分异构体 |