环境中氮氧化物的合理控制和治理是减少雾霾天气、优化生存环境的有效途径之一。请运用化学反应原理知识,回答下列问题:
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4 (g)+ 4NO2 (g)="==" 4NO(g)+ CO2 (g)+ 2H2O(1) △H1 = -662kJ·mol-1
②CH4 (g)+ 4NO(g) ="==" 2N2 (g)+ CO2 (g)+ 2H2O(1) △H2 =" -1251" kJ·mol-1
据此,写出CH4将NO2还原为N2的热化学方程式:
(2)用活性炭还原法也可处理氮氧化物。有关反应为:C(s)+2NO(g)  N2 (g)+CO2 (g)
N2 (g)+CO2 (g)
某研究小组向一个容积(3L)恒定的真空密闭容器中加人0.3mol NO和足量的活性炭与催化剂(固体试样的体积忽略不计),在恒温(T1℃)条件下发生反应,经10min反应达到平衡,测得N2的物质的量为0.09mol。
①0min~10min内以v(NO)表示的平均化学反应速率为 。
②下列各项能判断该反应达到平衡状态的是 。
| A.容器内压强保持不变 |
| B.速率关系:2v(NO)(正) =" v" (N2)(逆) |
| C.容器内CO2的体积分数不变 |
| D.混合气体的密度保持不变 |
③在相同条件下,若在容器中放入生石灰,则NO的平衡转化率 (填“增大”、“不变”或“减小”)。
下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝,X分解产生A、B、C三种产物的比值为1:1:1。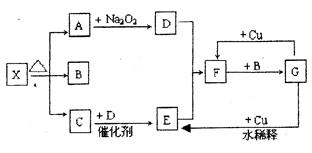
(1)写出下列各物质的化学式:
X:;B:;F:;G:。
(2)按要求写出下列变化的反应化学方程式:
A→D的化学反应方程式:;
G→E的离子反应方程式:。
下表是元素周期表的前三周期,针对表中A~G七种元素填空:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|||||||
| 2 |
B |
C |
D |
|||||
| 3 |
E |
F |
G |
(1)A、B两种元素组成相对分子质量最小的化合物,其分子的空间结构为。
(2)七种元素中的最高价氧化物对应水化物的酸性最强的是(用化学式表示,下同);碱性最强的是,该化合物属于。(选填离子或共价化合物),该化合物的电子式为,所含化学键类有、。
(3)用A、D的单质可以制成燃料电池,电池中装有E的最高价氧化物的水化物的浓溶液作电解质溶液,用多孔的金属惰性电极浸入上述浓溶液中,在X极通入D的单质,Y极通入A的单质,则Y极是该电池的极(选填正极或者负极),X极的电极反应式是。当电池中转移1mol 电子时,消耗A单质的体积为L(标况)。
下面列出了几组物质,请将物质的合适组号填写在空格上。
① 氧气(O2)与臭氧(O3); ②16O、17O和18O; ③ CH4和CH3CH2CH3;
④ ⑤(CH3)2CHCH2CH3 和C(CH3)4
⑤(CH3)2CHCH2CH3 和C(CH3)4
(1)同位素;(2)同种物质;(3)同分异构体;(4) 同系物。
胃酸过多可服用Al(OH)3胶囊或NaHCO3粉剂等进行治疗,试写出它们分别和胃酸的主要成分HCl反应的离子方程式:、
,但如果胃部已出现溃疡,则不可服用上述两种制剂中的 (填写物质的化学式) 。
(1)汽车尾气(含有烃类、CO、SO2与NO等物质)是城市的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。它的作用之一是使CO与NO反应,生成两种无毒气体,试写出CO与NO反应的化学方程式:。
(2) 经研究,光化学烟雾的有害物质中含有臭氧,其形成过程与二氧化氮有关,这个过程实际上包含了三个反应:①NO2 NO+O、②2NO+O2= 2NO2、③O2+O = O3。则总反应可表示为,NO2在其中起了作用。
NO+O、②2NO+O2= 2NO2、③O2+O = O3。则总反应可表示为,NO2在其中起了作用。