研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+8NH3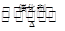 7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
7N2+12H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下的体积是________L。
(2)已知:2SO2(g)+O2(g)  2SO3(g) ΔH="—196.6" kJ/mol ;
2SO3(g) ΔH="—196.6" kJ/mol ;
2NO(g)+O2(g)  2NO2(g) ΔH="—113.0" kJ/mol ;
2NO2(g) ΔH="—113.0" kJ/mol ;
①则反应NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH 的ΔH=________。
SO3(g)+NO(g) ΔH 的ΔH=________。
②一定条件下,将NO2与SO2以体积比1∶2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___ _____。
| A.体系压强保持不变 |
| B.混合气体颜色保持不变 |
| C.SO3和NO的体积比保持不变 |
| D.每消耗1 mol SO3的同时生成1 mol NO2 |
③测得上述反应平衡时NO2与SO2的体积比为1∶6,则平衡常数K=__ ______。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)  CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。
CH3OH(g) ΔH。CO在不同温度下的平衡转化率与压强的关系如图所示。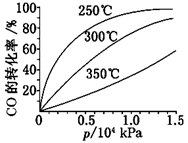
该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250℃、1.3×104 kPa左右,选择此压强的理由是______________________ 。
已知溶液中:还原性HSO3->I-,氧化性IO3-> I2 > SO42-。在含3 molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,试回答下列问题: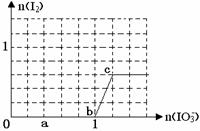
(1)写出a点反应的离子方程式;
反应中还原剂是;被还原的元素是。
(2)写出b点到c点反应的离子方程式。
(3) 当溶液中的I-为0.4 mol时,加入的KIO3为mol。
当溶液中的I-为0.4 mol时,加入的KIO3为mol。
(4)若往100 mL1mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为
。
下表为元素周期表短周期的一部分。回答下列问题:
| A |
D |
|||
| E |
G |
M |
(1)E元素原子核外有2个未成对电子,这2个电子所处亚层的符号是;请从物质的类别、化合价二方面归纳该元素+4价氧化物的化学性质:。
(2)请指出G的非金属性比E的非金属性强的事实(写3)。 (3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,且E离子的半径更大,请解释。
(3)E、G元素的原子均可形成与M原子电子层结构相同的简单离子,且E离子的半径更大,请解释。
(4)A与氢元素形成分子的空间结构可能是(选填序号)。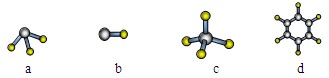
有浓度为0.1 mol•L-1的盐酸、硫酸、醋酸三种溶液,试回答:
(1)三种溶液中c(H+) 依次为a mol·L-1,b mol·L-1,c mol·L-1,其大小顺序为__________。
(2)等体积的以上三种酸分别与过量的NaOH 溶液反应,生成的盐的物质的量依次为
n 1mol,n2 mol,n3 mol,它们的大小关系为____________。
(3)中和一定量NaOH溶液生成正盐时,需上述三种酸的体积依次是V1L、V2L、V3L,其大小关系为____________。
(4)与锌反应时产生氢(气)的速率分别为v1、v2、v3,其大小关系为____________。
若以铁棒、碳棒、导线和氯化铁溶液为用品设计原电池。电池反应式为_________________________。
某温度(t℃)时,水的KW=10-13则该温度(填大于、等于或小于)______25℃,理由是________________________________________________