目前“低碳经济”正成为科学家研究的主要课题。请回答下列问题:
I.甲烷自热重整是一种先进的制氢方法,其反应方程式为:
CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)
(1)阅读下图,计算该反应的反应热ΔH = __________kJ/mol。
II.用CH4或其他有机物、O2为原料可设计成燃料电池。
(2)以CnH2nOn、O2为原料,H2SO4溶液为电解质设计成燃料电池,则负极的电极反应式为______________________________________________________________________。
(3)以CH4、O2为原料,100 mL 0.15 mol/L NaOH溶液为电解质设计成燃料电池,若放电时参与反应的氧气体积为448 mL(标准状况),产生的气体全部被溶液吸收,则所得溶液中溶质的成分及物质的量之比为____________________,各离子浓度由大到小的顺序为___________________。
III.利用I2O5消除CO污染的反应为:5CO(g) + I2O5(s) 5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答:
5CO2(g) + I2(s),不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数随时间t变化曲线如图。请回答: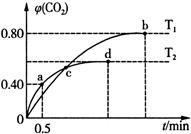
(4)T2时,0 ~ 0.5 min内的反应速率v(CO) = ____________________。
(5)T1时化学平衡常数K = ____________________。
(6)下列说法不正确的是____________________(填字母序号)。
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的压强相等 |
| C.d点时,增大体系压强,CO的转化率不变 |
| D.b点和d点时化学平衡常数的大小关系:Kb < Kd |
把在空气中久置的铝片5.0 g投入盛有 500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间可用如下的坐标曲线来表示,回答下列问题:
(1)曲线由0→a段不产生氢气的原因是,有关的化学方程式为;
(2)曲线由a→b段产生氢气的速率较慢的原因是:;
(3)曲线由b→c段,产生氢气的速率增加较快的主要原因:;
(4)曲线由c以后,产生氢气的速率逐渐下降的主要原因:。
(1)下图左表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;
b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处. 
(2)发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水。
已知:(a) N2 (g) + 2O2 (g) = 2NO2 (g)△H =" +" 67.7kJ/mol
(b) N2H4 (g) +O2 (g) = N2(g) +2H2O (g) △H = -543kJ/mol
(c) 1/2H2 (g) + 1/2F2 (g) = HF (g) △H = -269kJ/mol
(d) H2 (g) + 1/2O2 (g) = H2O (g) △H = -242kJ/mol
①肼和二氧化氮反应的热化学方程式为;
②有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式: 。
(14分)汽车尾气中CO、NOx 以及燃煤废弃中的SO2都是大气污染物,对它们的治理具有重要意义。
Ⅰ.①CH4(g)+4NO2(g) = 4NO(g)+CO2(g)+2H2O(g)△H1= —574 kJ·mol- 1.
②CH4(g) + 4NO(g) = 2N2(g)+CO2(g)+2H2O(g)△H2= 一1160 kJ·mol- 1
(1)甲烷直接将NO2还原为N2的热化学方程式为;
Ⅱ.吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):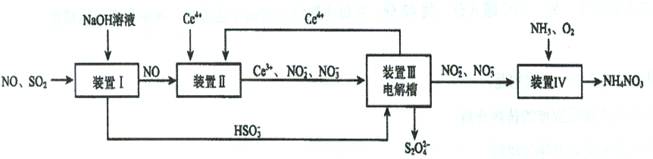
(2)装置Ⅱ中,酸性条件下,NO被Ce 4+ 氧化的产物主要是NO3- 、NO2- ,写出只生成NO3- 的离子方
式;
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。
①生成的Ce4+ 从电解槽的(填字母序号)口流出;
②生成S2O42 - 的电极反应式为;
(4)已知进入装置Ⅳ的溶液中,NO2- 的浓度为a g·L- 1 ,要使1m3该溶液中的NO2- 完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的O2L。(用含a代数式表示,计算结果保留整数)
(16分)A、B、C、D、E为原子序数依次增大的短周期元素,其中只有一种是金属元素。A、D元素原子最外层电子数相同,且A和D可形成离子化合物,C2 - 和D+ 具有相同的电子数,E元素的最高正化合价与最低负化合价之和为2。由这些元素组成的物质,其组成和结构信息如下表:
请用化学用语回答下列问题:
(1) D+ 的结构示意图为;
(2) C、D、E的氢化物按熔点由高到低排列的顺序为;
(3) 乙属于分子(填“极性”或“非极性”),丁的电子式为,
(4) 将少量甲投入到AlCl3溶液中反应的离子方程式为;
(5) 丙属于晶体,丙中每个原子均形成4个共价键,其中有一个配位键,提供空轨道的是;
氮化硼晶体的熔点要比丙晶体高,其原因是。
重要的精细化学晶M和N,常用作交联剂、涂料、杀虫剂等,合成路线如下图所示: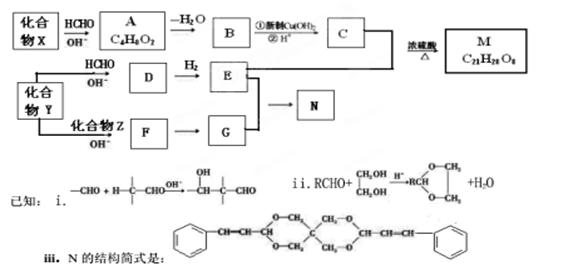
请回答下列问题:
(1)A中氧官能团的名称为__________________.由A生成B的反应类型为________________
(2)X的结构简式为______________________
(3)由B生成C的反应①的化学方程式为______________________
(4)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式为___________
(5)E的结构简式为_______________,E的同分异构体有多种,其中与E具有相同官能团的同分异构体有_____________种(提示:同一碳原子上连有两个或以上羟基是不稳定的,)试写出其中一种的结构简式______________.
(6)下列说法正确的是()
| A.E能发生消去反应 | B.1mol M中含有4mol 酯基 |
| C.X与Y是同系物 | D.1mol G与足量H2加成可消耗2mol H2 |
(7)由Y生成D的化学方程式为_________________________
(8)Z的结构简式为___________________________.
(9)由F生成G的化学方程式为__________________________.