常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使甲基橙变红的溶液:Fe2+、K+、SO42-、NO3- |
| B.含0.1mol·L-1 KI的溶液:Fe3+、Na+、NO3-、Cl- |
| C.0.1 mol·L-1NaAlO2溶液:K+、OH-、Cl-、NO3- |
| D.水电离出的c(H+)=10-12 mol·L-1的溶液:Na+、K+、NH4+、CO32- |
下列各实验,不可能成功的是()
①蒸馏普通酒精制无水乙醇;②苯与浓硫酸混合加热至60℃制硝基苯;
③用苯和溴水混合制溴苯;④用裂化汽油从碘水中提取碘
| A.只有①和④ | B.只有②和③ | C.只有①和③ | D.①②③④ |
100 mL 6 mol·L-1的H2SO4溶液跟过量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
①Na2CO3溶液 ②水 ③K2SO4溶液 ④KNO3溶液
| A.①③ | B.②③ | C.①④ | D.②④ |
现有乙酸、乙烯和丙烯(C3H6)的混合物,其中氧的质量分数为a,则碳的质量分数是()
A. |
B.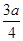 |
C.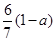 |
D.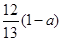 |
某有机物的结构如图,这种有机物不可能具有的性质是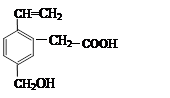
| A.能使Br2的四氯化碳溶液褪色 |
| B.能发生酯化反应 |
| C.能发生水解反应 |
| D.能跟Na反应 |
下列实验方案不合理的是( )
| A.除去乙烷中含有的乙烯:将气体通入溴水中,洗气 |
| B.检验蔗糖是否水解:取1mL 20%的蔗糖溶液,加3~5滴稀硫酸。水浴加热5min后取少量溶液,加氢氧化钠溶液调溶液pH至碱性,再加入少量新制备的Cu(OH)2,加热3~5 min,观察实验现象 |
| C.除去乙酸乙酯中的乙酸:加入浓硫酸和乙醇,加热 |
| D.鉴别己烯和苯:将溴的四氯化碳溶液分别滴加到少量己烯和苯中 |