某研究性学习小组用下列装置(铁架台等支撑仪器略)探究氧化铁与乙醇的反应,并检验反应产物。
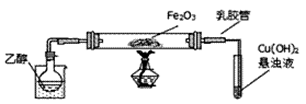
(1)装入试剂之前,需要进行什么操作: ;为快速得到乙醇气体,可采取的方法是 ;若实验时小试管中的溶液已经开始发生倒吸,你采取的措施是_________(填写编号);
a.取下小试管 b.移去酒精灯
c.将导管从乳胶管中取下 d.以上都可以
(2)盛Cu(OH)2悬浊液的试管中可能出现的现象为___________________。
(3)如图实验,观察到红色的Fe2O3全部变为黑色固体(M),充分反应后停止加热。为了检验M的组成,进行下列实验。
①M能被磁铁吸引;加入足量稀硫酸,振荡,固体全部溶解,未观察到有气体生成;
②经检验溶液中有Fe2+和Fe3+;
关于M 中铁元素价态的判断正确的是 (填写编号)。
a.一定有+3价和+2价铁,一定无0价铁 b.一定有+3价、+2价和0价铁
c.一定有+3价和0价铁,一定无+2价铁 d.一定有+3和+2价铁,可能有0价铁
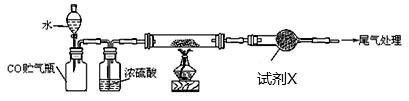
(4)若M的成份可表达为FeXOY,用CO还原法定量测定其化学组成。称取a g M样品进行定量测定,实验装置如上图,步骤如下。
①组装仪器;②点燃酒精灯;③加入试剂;④打开分液漏斗活塞;
⑤检查气密性;⑥停止加热;⑦关闭分液漏斗活塞;⑧……。
正确的操作顺序是__________(填写编号)
a.①⑤④③②⑥⑦⑧ b.①③⑤④②⑦⑥⑧
c.①⑤③④②⑥⑦⑧ d.①③⑤②④⑥⑦⑧
实验装置中盛水的仪器名称是 ;试剂X为 。
(5)若实验中每步反应都进行完全,反应后M样品质量减小b g,则FeXOY中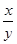 =_____。
=_____。
黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验: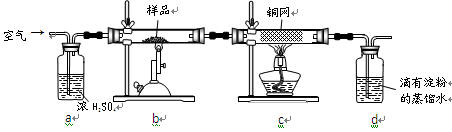
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的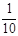 置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.10mL,末读数如右图所示。
置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.10mL,末读数如右图所示。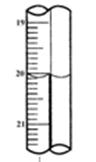
请回答下列问题:
1、称量样品所用的仪器为,将样品研细后再反应,其目的是
。
2、装置a的作用是。
A、有利于空气中氧气充分反应 b、除去空气中的水蒸气
C、有利于气体混合 d、有利于观察空气流速
3、上述反应结束后,仍需通一段时间的空气,其目的是
。
4、滴定时,标准碘溶液所耗体积为mL。判断滴定已达终点的现象是______。
5、通过计算可知,该黄铜矿的纯度为。
6、若用右图装置替代上述实验装置d,同样可以达到实验目的的是。(填编号)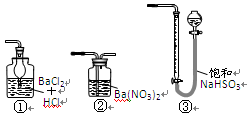
15分)某兴趣小组同学设计了如下装置(其中夹持仪器、加热仪器及冷却水管没有画出),用加热苯甲酸、浓H2SO4和乙醇混合物的方法来制备苯甲酸乙酯,并检验反应的部分副产物。且苯甲酸乙酯的沸点为213℃,乙醚的沸点为34.6℃。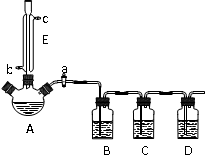
⑴关闭活塞a、接通竖直冷凝管的冷凝水,给A加热30分钟,制备。仪器E的作用是。
⑵上述反应的副产物可能有:乙醚(CH3CH2-O-CH2CH3)、乙烯、SO2、水等。
①打开活塞a,在竖直冷凝管上方塞上塞子,通过B、C、D装置检验SO2和乙烯。已知C中盛放的试剂是NaOH溶液,B、D中应盛放的试剂依次分别是。
②有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”,来确定副产物中存在乙醚。请你对该同学的观点进行评价:。
⑶通过下列实验方案,可以提纯苯甲酸乙酯。
①为除去产品中杂质,先将三口烧瓶中残液倒入盛有冷水的烧杯中,并加入。
②用分液法可分离上述有机层和水层,分液完成后,取出有机层的操作是。
③向锥形瓶中加入适量豆粒大小的无水氯化钙干燥剂,至醚层澄清透明;过滤得醚层,然后将醚层加入到干燥的蒸馏烧瓶中蒸馏,蒸馏过程中控制的温度为。
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且半分钟内颜色不再改变为止,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶加入5mL的蒸馏水,测得所耗盐酸的体积为V2 mL。试回答下列问题:
(1)锥形瓶中的溶液从色变为 色时,停止滴定。
(2)该小组在步骤①中的错误是,
由此造成的测定结果(偏高、偏低或无影响)。
(3)如图,是某次滴定时的滴定管中的液面,其读数为mL。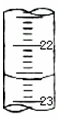
(4)根据下列数据:
| 滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
| 滴定前读数(mL) |
滴定后读数(mL) |
||
| 第一次 |
20.00 |
0.50 |
25.40 |
| 第二次 |
20.00 |
4.00 |
29.10 |
请计算待测烧碱溶液的浓度为。
(16分,每空2分)已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题: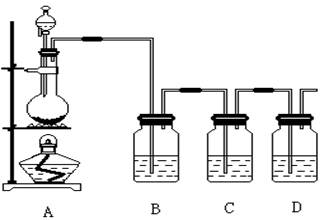
(1)装置A的分液漏斗中盛装的试剂是,烧瓶中的化学反应方程式 。
(2)装置B所加试剂饱和NaCl溶液,其装置的作用是。
(3)装置C中盛放的试剂是(选填下列所给试剂的代码),实验现象为,
该反应的离子方程式是。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-易被氧化;④HCl比H2S稳定;⑤铜与盐酸不反应,但能与浓硫酸反应;⑥铁与氯气加热生成三氯化铁,铁与硫加热生成硫化亚铁;⑦硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可说明氯比硫非金属性强的是
A.全部 B.②③④⑥⑦ C.①②④⑤⑥ D.除 ①以外
(5)装置D中盛放烧碱溶液,目的是吸收反应后剩余的气体,防止污染空气,写出反应的离子方程式。
为了验证Cu和 浓H2SO4反应的产物中有SO2和H2O,选用下图所示仪器(内含物质)组装成实验装置 . B中有无水硫酸铜、C中有品红、D中有氢氧化钠溶液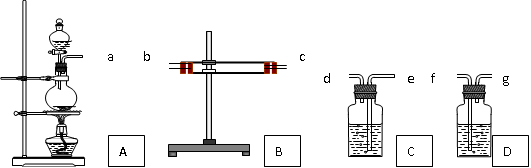
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):a接 , 接 , 接 ;
(2) 仪器B、C应有怎样的实验现象才表明已检验出SO2和H2O?
B中 ,C中 ;
(3)D中氢氧化钠溶液的作用是
(4)写出A中反应的化学方程式 .