在1981年才第一次制得卤族元素的第五个成员砹,根据卤素性质的变化规律,我们可以预料到砹有下列性质:
(1)砹在室温下的状态是 体,颜色比碘 ,它夺电子能力比碘 , (填“有”或“没有”)挥发性,并 (填“溶”或“不溶”)于四氯化碳。
(2)AgAt的颜色比AgI , 溶于水,HAt的稳定性比HI 。
(3)单质砹是卤素中 的氧化剂,而砹离子是卤族中 的还原剂。(填“最强”或“最弱”)
短周期的五种元素A、B、C、D、E,原子序数依次增大。A、B、C三种元素电子层数之和是5。A、B两元素原子最外层电子数之和等于C元素原子最外层电子数;B元素原子最外电子层上的电子数是它的电子层数的2倍,A与D可以形成原子个数比分别为1∶1和2∶1的两种液态化合物;E单质用于净化水质。
请回答:
(1)写出D在元素周期表中的位置 ,
E的原子结构示意图是 。
下列可以验证C与D两元素原子得电子能力强弱的实验事实是 (填写编号)。
A.比较这两种元素的气态氢化物的沸点
B.比较只有这两种元素所形成的化合物中的化合价
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢气化合的难易
(2)由A、B两种元素组成的最简单的化合物,写出其电子式 。
(3)均由A、B、C、D四种元素组成的甲、乙两种化合物,都既可以与盐酸反应又可以与NaOH溶液反应,甲为无机盐,其化学式为 ,乙为天然高分子化合物的水解产物,且是同类物质中相对分子质量最小的,其结构简式为 。
(4)胶态磁流体在医学上有重要的用途,而纳米级Fe3O4是磁流体中的重要粒子,其制备过程可简单表示如下:
①将化合物CA3通入等物质的量的FeSO4、Fe2(SO4)3的混合溶液中,生成两种碱,写出该反应过程的总的离子方程式 。
②上述反应生成的两种碱继续作用,得到Fe3O4。
(5)已知下表数据:
| 物质 |
Fe(OH)2 |
Fe(OH)3 |
| Ksp/25 ℃ |
2.0×10-16 |
4.0×10-36 |
若使混合液中FeSO4、Fe2(SO4)3的浓度均为2.0 mol·L-1,则混合液中c(OH-)不得大于 mol·L-1。
如图是元素周期表中截取的一个片段,其中X、Y、Z、W均属于短周期元素。请回答下列问题:
(1)若X单质为空气的主要成分之一,则W原子结构示意图为 。
(2)若Y、W、Z的最高价氧化物对应的水化物依次为一元酸、二元酸、三元酸,这三种酸的正盐的含氧酸根离子中,有两种的电子数相等,则这两种离子的符号是 、 。
(3)若Na与Y和Z的单质分别反应可以生产摩尔质量相同的两种化合物,其中Na与Y形成的化合物的电子式为 ,所含化学键的类型为
(4)Y元素在周期表中可能处于第 纵行(写出所有可能纵行数)。
短周期元素A、B、C、D在周期表中的位置如图,E2+与D的简单阴离子有相同的电子层结构,回答下列问题: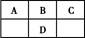
(1)设A、B、C、D四种元素的原子序数之和为m,则m 。
A.一定为奇数
B.一定为偶数
C.可能为奇数,也可能为偶数
(2)D元素原子的次外层电子数等于其他层电子数之和,则:
①写出A形成的简单离子的结构示意图 ,元素D位于元素周期表的第 族。
②A元素的一种氢化物分子中有6个原子,其结构简式为 。常压298 K时0.2 mol该气态氢化物在O2中完全燃烧,生成气态A单质和水,放出热量106.8 kJ,该气态氢化物燃烧的热化学方程式为 。
③写出C单质与B的最简单氢化物反应的化学方程式:
④实验证实AC3与水会发生反应生成HNO2和HF,则AC3和NaOH溶液反应的化学方程式为 。
为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为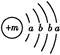 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+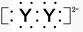
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2- 2Y-+Z↓
2Y-+Z↓
D.用电子式表示XY2的形成过程为: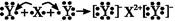
四种短周期非金属元素A、B、C、D原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是
(2)化合物CA3的电子式是 ,BD2分子的结构式为
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为 。