在容积固定的密闭容器中发生反应:Fe(s)+CO2(g)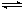 FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700 ℃时平衡常数为1.47,900 ℃时平衡常数为2.15。下列说法正确的是
| A.从700 ℃到900 ℃,平衡体系中气体的密度变大 |
B.该反应的化学平衡常数表达式为K=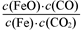 |
| C.绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 |
| D.该反应的正反应是放热反应 |
2014年我国纪念“世界水日”活动的宣传主题为“加强河湖管理,建设水生态文明”。下列与水相关的叙述正确的是
| A.加聚反应也可能有水生成 |
| B.有水参加的有机化学反应都可以叫做水解反应 |
| C.水可以参与有些有机反应,有些有机反应也有水生成 |
| D.水、乙醇、氢氧化钠中都存在羟基 |
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
| 50ml盐酸 |
50ml盐酸 |
50ml盐酸 |
|
| m(混合物) |
9.2g |
13.8g |
27.6g |
| V(CO2)(标况) |
2.24L |
3.36L |
3.36L |
A.13.8g混合物恰好能与50ml盐酸完全反应
B.根据表中数据不能计算出混合物中NaHCO3的质量分数
C.向50ml盐酸中加入混合物27.6g时,盐酸过量
D.盐酸的物质的量浓度为5.0mol/L
X、Y、Z、R、W是原子序数依次增大的短周期主族元素,它们原子的最外层电子数之和为21。X与Z同主族,Y与R同主族,Y是地壳中含量最多的元素。下列叙述正确的是
| A.原子半径:Y>Z>X |
| B.Y的气态氢化物的热稳定性比R的强 |
| C.R的最高价氧化物的水化物酸性比W的强 |
| D.Y与Z形成的化合物只有1种 |
将锌棒和石墨棒按图示方式插入CuSO4溶液中,电流计指针发生偏转,下列针对该装置的说法正确的是
| A.将电能转变为化学能 |
| B.电子由石墨棒流出 |
| C.锌为正极 |
| D.电池反应为:Zn + CuSO4 = ZnSO4 + Cu |
下列反应中生成物总能量大于反应物总能量的是
| A.石灰石在高温下的分解反应 | B.生石灰和水的反应 |
| C.盐酸与氢氧化钠溶液的反应 | D.木炭在氧气中燃烧 |