卤代烃在生产生活中具有广泛的应用,回答下列问题:
(1)多卤代甲烷常作为有机溶剂,其中分子结构为正四面体的是_________ .工业上分离这些多氯代甲烷的方法是_________ .
(2)三氟氯溴乙烷(CF3CHClBr)是一种麻醉剂,写出其所有同分异构体的结构简式_________ (不考虑立体异构).
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
反应①的化学方程式为_________ ,反应类型为_________ ;反应②的反应类型为_________ .
(14分)有两只密闭容器A和B,A能保持恒容,B能保持恒压。起始时向容积相等的A、B中分别通入等量的NH3气体,使之发生反应:2NH3(g) 3H2(g)+N2(g),并达到平衡。则:
3H2(g)+N2(g),并达到平衡。则:
(1)达到平衡所需要的时间:t(A)t(B),NH3的转化率:a(A)a(B) (填“>”、“=”或“<”)。
(2)反应过程中的反应速率:v(A)v(B) (填“>”、“=”或“<”)。
(3)达到平衡后,在两容器中分别通入等量的氦气。则B中的化学平衡向反应方向移动,A中的化学反应速率(填“增大”、“减小”或“不变”)。
(4)达到平衡后,向两容器中分别通入等量的原反应气体,再次达到平衡时,A容器中H2的百分含量,B容器中NH3的百分含量(填“增大”、“减小”或“不变”)。
(12分)氨在国民经济中占有重要的地位,请参与下列探究。
(1)生产氢气:将水蒸气通过红热的炭即产生水煤气。
C(s) + H2O(g) H2(g) + CO(g),ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
H2(g) + CO(g),ΔH =" +131.3" kJ·mol-1,ΔS =" +133.7" J·mol-1·K-1
该反应在低温下能否自发进行(填:“能”或“否”)。
(2)已知在400℃时,N2 (g)+ 3H2(g) 2NH3(g)的K=0.5,
2NH3(g)的K=0.5,
①2NH3(g) N2 (g)+ 3H2(g)的K=(填数值)。
N2 (g)+ 3H2(g)的K=(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应v(N2)正v(N2)逆(填:>、<、=、不能确定)
(3)在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是(填字母)。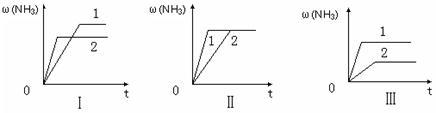
| A.图Ⅰ可能是不同压强对反应的影响,且P2>P1 |
| B.图Ⅱ可能是不同压强对反应的影响,且P1>P2 |
| C.图Ⅲ可能是不同温度对反应的影响,且T1>T2 |
| D.图Ⅱ可能是同温同压下,催化剂性能,1>2 |
Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g);ΔH=E1①
C(s)+H2O(g)=CO(g)+H2(g)ΔH=E2②
H2(g)+1/2O2(g)=H2O(g);ΔH=E3③
CO(g)+1/2O2(g)=CO2(g);ΔH=E4④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即。
(2)上述四个热化学方程式中ΔH>0的反应有。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是。
| A.a比b多 | B.a比b少 | C. a与b在理论上相同 | D.两者无法比较 |
Ⅱ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为。
某学校化学科研小组从文献资料上获得如下信息:NaHCO3在潮湿的空气中会缓慢分解成Na2CO3、H2O和CO2。为了验证这一信息,该科研小组将一瓶在潮湿空气中久置的NaHCO3样品混合均匀后,进行如下实验: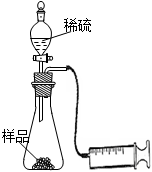
(1)在一个质量为ag的蒸发皿中加入一些样品,称得总质量为bg。用酒精灯对其充分加热,冷却后称得其总质量为cg。残留在蒸发皿中的固体是(填化学式)_________。
(2)另称取相同质量的样品放入锥形瓶中,实验装置如右图所示。打开活塞逐滴加入稀硫酸,至没有气泡产生为止。针筒中收集到气体折算成标准状况下的体积为VmL(滴入稀硫酸的体积及针筒活塞的内壁的摩擦力忽略不计)。该科研小组设称取的每份样品中的Na2CO3、NaHCO3的物质的量分别为x、y,且没有利用化学方程式进行计算,就列出了如下算式:x+y=VmL/22400mL·mol—1,他们依据的原理是_________。根据相似原理,请完成下列算式:2x+y=__________由上述两算式,该科研小组通过计算,得出了样品中的Na2CO3、NaHCO3的质量分数。
有一固体混合物,可能由Na2CO3、Na2SO4、CuSO4、CaCl2、NaCl等混合而成,为检验它们,做了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是,一定不含有的物质是,可能含有的物质是(以上空格均填写化学式)。对可能含有的物质,可采用向滤液中滴加溶液的方法来检验。
(2)写出步骤③中的离子方程式。