在一密闭容器中充入1molH2和1molI2,压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)=2HI(g)△H<0。
(1)保持容器容积不变,向其中加入1molH2,反应速率 理由是 。
(2)保持容器容积不变,向其中加入1molN2(N2不参加反应),反应速率 理由是 。
(3)保持容器内气体压强不变,向其中加入1molN2(N2不参加反应),反应速率________________,理由是________________。
(4)保持容器内气体压强不变,向其中加入1molH2(g)和1molI2(g),反应速率________________,理由是______________。
(5)提高反应的起始温度,反应速率______________,理由是______________。
若要除去下列各物质中的杂质,写出所用试剂:
(1)除去MgCl2中混有的少量MgCO3,可选用 溶液
溶液
(2)除去FeCl2中混有的少量Cu2+,可选用
(3)除去Fe粉中混有的少量Al粉,可选用 溶液
在金、钠、铁、铝几种金属中,在空气中最稳定的是 、最活泼的是;既能与酸反应又能与碱反应的是;适合于用热还原法冶炼的是。
我校某化学小组欲设计实验检验浓H2SO4和木炭反应的所有产物:
(1)写出浓H2SO4和木炭反应的化学方程式
(2)请你从下图中选用所需的仪器(可重复使用)组成一套装置帮助该小组实现他们的目的.现提供浓H2SO4、木炭和酸性KMnO4溶液,其他固、液试剂自选。(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)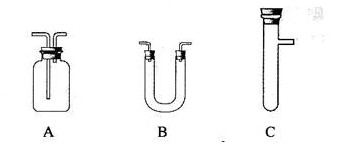
将所选的仪器按连接顺序由上至下依次填入下表(可以不填满,也可以补充),并写出该仪器中应加试剂的名称及其作用。
| 选用的仪器 (填字母) |
加入的试剂 |
作用 |
| (1) (2) (3) (4) (5) · · · |
胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:(1)白色结晶状粉末;(2)能溶于水,水溶液呈弱碱性;(3)受热分解;(4)
遇酸及酸性药物则产生二氧化碳;(5)胃酸过多患者服用后多见胃胀气,甚至有
引起溃疡穿孔的危险。
乙:(1)与胃酸的中和作用缓慢持久,可维持3~4小时;(2)凝胶本身覆盖于溃
疡面上,具有保护作用,并能吸附H+;(3)可溶于稀酸或氢氧化钠溶液。
(1)请你推测,甲中含有的主要化学成分是;乙中含有的主要化学成分是。
(2)试写出甲中含有的主要化学成分引起胃胀气的离子方程式
(3)试写出乙中含有的主要化学成分分别与稀盐酸和氢氧化钠溶液反应的离子方程式
氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水可以得到两种气体A和B。已知A为气体中摩尔质量最小的气体,B为黄绿色,A可以在B中安静的燃烧,产生苍白色的火焰;地壳中金属元素含量排行第二的C,其单质也可以在B燃烧,产生棕黄色的烟;B气体更普遍更重要的用途是与冷的消石灰反应 后产物可以用于漂白消毒。根据以上信息完成下列化学方程式:
后产物可以用于漂白消毒。根据以上信息完成下列化学方程式:
(1)A与B的反应
(2)C在B的反应
(3)B与消石灰的反应
(4)在输送B气体的管道有时可能会发生漏气,管道工人可以用浓氨水来检查是否漏气,已知能发生如下反应:B+ NH3→ N2 + HCl如果管道某处漏气,用该方法检查时会出现的现象是
写出B气体参与的总的化学方程式