非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题:
(1)非诺洛芬中的含氧官能团为 和 (填名称)。
(2)反应①中加入的试剂X的分子式为C8H8O2,X的结构简式为 。
(3)在上述五步反应中,属于取代反应的是 (填序号)。
(4)B的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式: 。
(5)根据已有知识并结合相关信息,写出以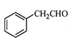 为原料制备
为原料制备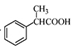 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:

写出下列反应的化学方程式
(1)过氧化钠与二氧化碳:
(2)二氧化硫与氧气:
(3)铜与浓硫酸:(标出电子转移的方向和数目)
(12分) 10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度(填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则(填“甲”或“乙”)判断正确。试剂X是。
A. Ba(OH)2溶液 B. BaCl2溶液 C. NaOH溶液 D. 澄清的石灰水
⑵将加热后的溶液冷却到10℃,若溶液的pH等于8.3,则(填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言(填“甲”或“乙”)判断是错误的,理由是。
250C时,如果取0.1 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因(用离子方程式表示);
(2)混合溶液中由水电离出的c(H+)0.1 mol·L-1 NaOH溶液中由水电离出的c(H+);(填>、<、=)
(3)求出混合液中下列算式的计算结果(填具体数字):
c (HA)+c (A-)=mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7 (填>、<、=);
(5)将相同温度下相同浓度的四种盐溶液:
A.NH4HCO3 B.NH4AC.(NH4)2SO4 D.NH4Cl
按pH由大到小的顺序排列(填序号)
已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向AgCl 和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:(250C时AgCl,Ag2S的溶解度分别为1.5 ×10-4 g, 1.3 × 10-16g)
(1)写出白色固体转化成黑色固体的化学方程式:
(2)白色固体转化成黑色固体的原因是:
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2。已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·moL-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6KJ·moL-1
H2O (g)=H2O(l) ΔH=-44.0KJ·moL-1
(1)氢气的标准燃烧热△H=kJ·moL-1
(2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式
(3)往 1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为;反应达到平衡后,升高温度,此时平衡常数将(填“变大”、“不变”或“变小”),平衡将向(填“正”或“逆”)方向移动
(4)为了提高CO的转化率,可采取的措施是。
| A.增大的CO浓度 | B.增大的H2O(g)浓度 | C.使用催化剂 | D.降低温度 |
(5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是