(2014年浙江卷)葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过以下反应制得:
C6H12O6(葡萄糖)+Br2+H2O→C6H12O7(葡萄糖酸)+2HBr
2C6H12O7(葡萄糖酸)+CaCO3→Ca(C6H11O7)2(葡萄糖酸钙)+H2O+CO2
相关物质的溶解性见下表:
| 物质名称 |
葡萄糖酸钙 |
葡萄糖酸 |
溴化钙 |
氯化钙 |
| 水中的溶解性 |
可溶于冷水 易溶于热水 |
可溶 |
易溶 |
易溶 |
| 乙醇中的溶解性 |
微溶 |
微溶 |
可溶 |
可溶 |
实验流程如下:

请回答下列问题:
(1)第①步中溴水氧化葡萄糖时,下列装置最合适的是________。
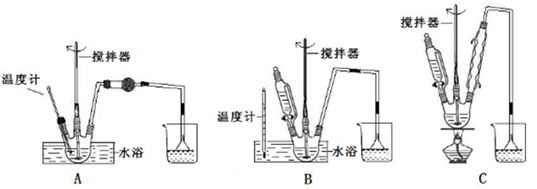
制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其它试剂,下列物质中最适合的是____。
A.新制Cu(OH)2悬浊液 B.酸性KMnO4溶液
C.O2/葡萄糖氧化酶 D.[Ag(NH3)2]OH溶液
(2)第②步充分反应后CaCO3固体需有剩余,其目的是________;本实验中不宜用CaCl2替代CaCO3,理由是________。
(3)第③步需趁热过滤,其原因是________。
(4)第④步加入乙醇的作用是________。
(5)第⑥步中,下列洗涤剂最合适的是________。
A.冷水 B.热水 C.乙醇 D.乙醇-水混合溶液
某化学课外活动小组设计实验探究氮的化合物的性质,装置如下图所示(A装置未画出),其中A为气体发生装置。A中所用试剂从下列固物质中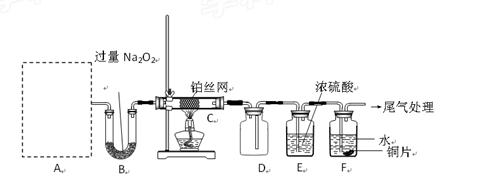
a. NH4HCO3、b. NH4Cl、c. Ca(OH)2、d. NaOH。
检查装置气密性后,先将C处铂丝网加热至红热,再将A处产生的气体通过B装置片刻后,撤去C处酒精灯。部分实验现象如下:铂丝继续保持红热,F处铜片逐渐溶解。
(1)实验室制取A中气体时若只用一种试剂,该试剂是________(填备选试剂的字母);此时A中主要的玻璃 仪器有________________(填名称)。
仪器有________________(填名称)。
(2)A中产生的物质被B中Na2O2充分吸收,写出任意一个B中发生反应的化学方程式:_____________________。
(3)对于C中发生的可逆反应,下列说法正确的是________。
a. 增大一种反应物的浓度可以提高另一种反应物的转化率
b. 工业上进行该反应时,可采取高压的条件提高反应物转化率
c. 该反应在一定条件下达到平衡时,反应物的平衡浓度之比一定是4∶5
(4)请在下图坐标中画出C装置中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式。
(5)待实验结束后,将B中固体混合物溶于500mL1mol·L-1盐酸中,产生无色混合气体甲,溶液呈中性,则实验前B中原有Na2O2的物质的量是____mol,甲在标准状况下是_____L(忽略气体的溶解)。
某化学课外活动小组进行了一系列“带火星的木条复燃”的实验,实验装置如下图。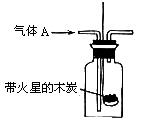
(1)甲组同学探究“使带火星木条复燃时O2的体积分数的极限”。将氧气和空气(假定空气中O2的体积分数为20%)按不同的体积比混合得100mL气体A进行实验,实验记录如下: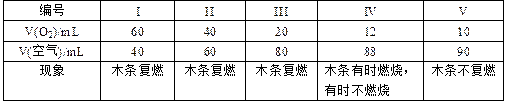
回答问题:
①使带火星木条复燃的O2的体积分数最小(第IV组数据)约为____________。
②用带火星木条检验集气瓶里是否集满O2,若木条复燃,能否认为集气瓶里的气体一定是纯净的O2?答:__________(填“能”或“否”)。
③若按照3:2的比例混合O2和CO2气体,该混合气体能否使带火星的木条复燃?答:___________(填“能”“否”或“不一定”)。
(2)乙组同学探究“NO2能否支持燃烧”的问题,设计了如下几组实验,实验记录及结论如下:
| 编号 |
制取气体A(下列反应产生的混合气体) |
B中的现象 |
结论 |
| a |
在烧瓶中加热适量浓HNO3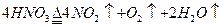 |
充满红棕色气体,木条不复燃,火星熄灭 |
NO2不支持燃烧 |
| b |
加热AgNO3固体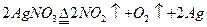 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
| c |
加热Cu(NO3)2固体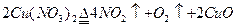 |
充满红棕色气体,木条复燃 |
NO2支持燃烧 |
你认为a、b、c三个结论是否可靠?若不可靠,说明原因;若可靠,则不需说明。
a. ___________,原因是______________________________。
b. ___________,原因是______________________________。
c. ___________,原因是______________________________。
向溴水中加入足量乙醛溶液,可以观察到溴水褪色。对产生该现象的原因有如
下三种猜想:①溴水与乙醛发生了取代反应;②溴水与乙醛发生了加成反应③溴水将乙醛氧化成乙酸。为探究哪一种猜想正确,一研究性学习小组提出了如下两种实验方案:
方案一:检验褪色后溶液的酸碱性
方案二:测定反应前溴水中Br2的物质的量和反应后Br-的物质的量
(1)方案一是否可行?,理由
(2)假设方案二中测得反应前溴水中Br2的物质的量为a mol,若测得反应后n(Br-)=
mol,说明溴水与乙醛发生了取代反应;若测得反应后n(Br-)=mol,说明溴水与乙醛发生了加成反应;若测得反应后n(Br-)=mol,则说明溴水将乙醛氧化成乙酸。
(1)指出在使用下列仪器(已经洗涤干净)或用品时的第一步操作:
①石蕊试纸(检验气体):___________________________________________。
②容量瓶:________________________________________________________。
③托盘天平________________________________________________________。
(2)①现有0.1mol/L的纯碱溶液,请用离子方程式表示纯碱溶液呈碱性的原因:___________________________________________________________________。
②为探究纯碱溶液呈碱性是由CO32-引起的,请你设计一个简单的实验方案:___________________________________________________________________。
实验室需要0.1mol/LNaOH溶液450mL,根据溶液配制中情况回答下列问题:
(1)实验中除了托盘天平、烧杯、容量瓶外还需要的其它仪器有:
。
(2)根据计算得知,所需NaOH的质量为g。
(3)下列操作对所配浓度有何影响(填写字母)偏大的有;偏小的有;无影响的有。
| A.称量用了生锈的砝码; |
| B.将NaOH放在纸张上称量; |
| C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中; |
| D.往容量瓶转移时,有少量液体溅出 |
E.未洗涤溶解NaOH的烧杯
F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液
H.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。