污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为MnO2,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已略去)。
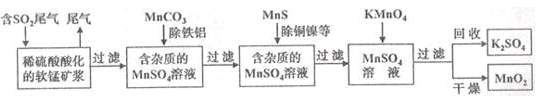
请回答下列问题:
(1)上述流程脱硫实现了____(选填下列字母编号)。
A.废弃物的综合利用
B.白色污染的减少
C.酸雨的减少
(2)用MnCO3能除去溶液中Al3+和Fe3+,其原因是_____。
(3)已知:25℃、101kpa时,Mn(s)+O2(g)=MnO2(s) △H=-520kJ/mol
S(s)+O2(g)=SO2(g) △H=-297kJ/mol
Mn(s)+S(s)+2O2(g)=MnSO4(s) △H=-1065kJ/mol
SO2与MnO2反应生成无水MnSO4的热化学方程式是________________。
(4)MnO2可作超级电容器材料。用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是____________________________。
(5)MnO2是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是____________________________________。
(6)假设脱除的SO2只与软锰矿浆中的MnO2反应。按照图示流程,将a m3(标准状况)含SO2的体积分数为b%的尾气通入矿浆,若SO2的脱除率为89.6%,最终得到MnO2的质量为c kg,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于MnO2___________kg。
15分) 某工厂从乙醇、乙酸、乙酸乙酯的混合物中分离、回收上述三种物质,设计了以下方案: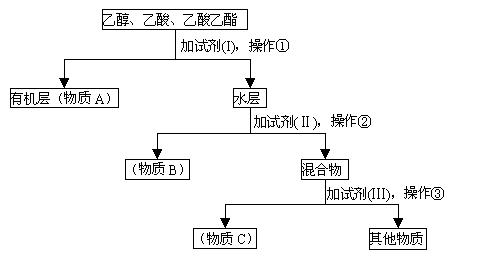
 (1)A、B、C是被回收的物质,它们分别是(写名称)
(1)A、B、C是被回收的物质,它们分别是(写名称)
A________________ B_________________ C___________________
(2)所用试剂分别是(写名称)I__________Ⅱ___________Ⅲ______________
(3)三步操作分别是①_______________②_______________③_______________。
(4)在实验室,操作①应在_______________(填仪器名称)中进行。
(5) 写出有乙酸和乙醇生成乙酸乙酯的化学反应方程式。
把10mL淀粉胶体和5mL KCl溶液的混合液体加入用半透膜制成的袋中,将此袋浸入蒸馏水中。2min后用两支试管各取5mL烧杯中的液体,并做如下实验:
(1)向其中一支试管中滴加少量AgNO3溶液,其现象是
;
(2)向另一支试管里滴加少量碘水,其现象是
;
(3)由上述现象可以得出的结论是
。
把相同物质的量浓度的盐酸、NaOH、NaCl、CH3COOH、NH3·H2O、C2H5OH溶液分别倒入六个烧杯中,接通电源。试回答:
(1)为什么连接C2H5OH的水溶液的灯泡不亮;其余的灯泡均亮了;
(2)为什么连接盐酸、NaOH、NaCl的水溶液的灯泡亮度一致,连接CH3COOH、NH3·H2O的水溶液的灯泡亮度一致且比连接HCl、NaOH、NaCl的水溶液的灯泡要暗。
现有失去标签的氯化钙、硝酸银、盐酸、碳酸钠四种无色溶液,为了鉴别四种溶液各是什么,将它们随意编号为A、B、C、D后,按下表进行实验,产生的现象如下表所示。
试根据实验现象回答:
| 实验顺序 |
实验内容 |
实验现象 |
| ① |
A+B |
没有现象发生 |
| ② |
B+D |
有气体放出 |
| ③ |
C+B |
有沉淀生成 |
| ④ |
A+D |
有沉淀生成 |
(1)推断并写出各物质的化学式:
A、B、C、 D。
(2)写出各序号实验中有关反应的离子方程式,不反应的说明理由。
①
②
③
④
如图所示,在一烧杯中盛有H2SO4溶液, 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题: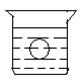
 (1)该实验中,观察到的现象有
(1)该实验中,观察到的现象有
①,
②。
(2)写出该实验中反应的离子方程式
。