硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
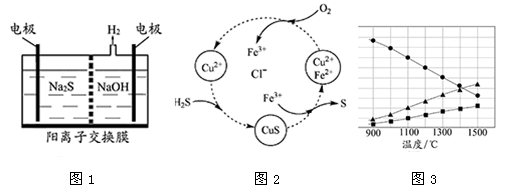
(1)将烧碱吸收H2S后的溶液加入到如图1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应:S2-—2e- S (n—1)S+ S2-
S (n—1)S+ S2- Sn2-
Sn2-
①写出电解时阴极的电极反应式: 。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成 。
(2)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图2所示。
①在图示的转化中,化合价不变的元素是 。
②反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+的物质的量不变,需要消耗O2的物质的量为 。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有 。
(3)H2S在高温下分解生成硫蒸气和H2。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如图3所示,H2S在高温下分解反应的化学方程式为 。
现有mg某气体,它由四原子分子构成,它的摩尔质量为Mg·mol-1。则:
(1)该气体的物质的量为__________________mol;
(2)该气体所含原子总数为________________个(用NA表示即可);
(3)该气体在标准状况下的体积为_____________L;
(4)该气体溶于水后形成 V L溶液,其溶液的物质的量浓度为____________ mol·L-1;
(5)该气体溶于a ml 水中(假设该气体与水不反应),所得溶液溶质质量分数为_______。
(12分
下图是元素周期表的一部分:
⑴表中区域名称s、p……等确定的依据是_______________________________________。
⑵已知A原子的M层和N层的电子数分别比B原子的M层和N层的电子数少7个和4个,则A的核外电子排布式为______________,B在元素周期表中的位置是___________。
⑶上表中元素x的一种氢化物的晶体结构如图所示,写出该化合物在氯气中燃烧的化学方程式。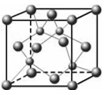
除x外,第四周期中最外层只有一个电子的还有(填元素名称)。
⑷表中短周期非金属元素之间可以形成形形色色的有机物,如邻羟基苯甲醛(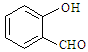 )和对羟基苯甲醛(
)和对羟基苯甲醛(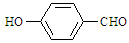 ),前者沸点低于后者,理由是
),前者沸点低于后者,理由是
_____。
(14分)氟和氟盐是化工原料。由于氟气性质活泼,很晚才制取出来。
(1)不能通过电解纯净的液态HF获得F2,其原因是;但电解液态KHF2时,两极分别得到F2和H2,写出阳极上HF2- 放电产生气体的电极反应式。
(2)利用K2MnF6和SbF5在一定条件下发生反应也能制取氟,同时生成KSbF6和MnF3,化学方程式为,其中还原产物是。
(3)已知氟化氢气体中存在下列平衡:H3F3 3HF △H>0, H2F2
3HF △H>0, H2F2 2HF △H>0。
2HF △H>0。
①若在定温定容条件下再充入H3F3,则H3F3与HF的浓度(mol/L)比值(填“增大”“减小”或“不变”,下同);
②若在定温定容条件下再充入HF,则H3F3与HF的浓度(mol/L)比值。
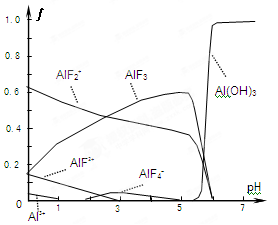
(4)一定浓度的HF和Al2(SO4)3混合液中,铝的各种微粒含量?随pH的分布曲线如图示。用NaOH使混合液的pH从5调整到7,写出有关反应的离子方程式为
。
_
(15分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程:
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为。
(2)混合①中使用冰水的目的是。
(3)操作Ⅱ和操作Ⅲ的名称分别是、。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则 用于证明该假设所用的试剂为,若假设成立可观察到的现象为。
用于证明该假设所用的试剂为,若假设成立可观察到的现象为。
乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂。
饮用水中含有一定浓度的NO3一将对人类健康产生危害,NO3一能氧化人体血红蛋白中的Fe(II),使其失去携氧功能。为了降低饮用水中NO3一的浓度,某兴趣小组提出如下方案:
请回答下列问题:
⑴已知过滤后得到的滤渣是一种混合物,则在溶液中铝粉和NO3一反应的离子方程式为
__________________________________________。
⑵该方案中选用熟石灰调节pH,理由是_______________________、__________________,在调节pH时,若pH过大或过小都会造成的利用率降低。
⑶用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物均可参与大气循环,则催化还原法的离子方程式为____________________________________。
⑷饮用水中的NO3-主要来自于NH4+。已知在微生物作用的条件下,NH4+经过两步反应被氧化成NO3-。两步反应的能量变化示意图如下:
试写出1 mol NH4+(aq)全部氧化成NO3-(aq)的热化学方程式是。