A、B、D、E、F为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在D中充分燃烧能生成其最高价化合物BD2。E+与D2-具有相同的电子数。A在F中燃烧,产物溶于水得到一种强酸。回答下列问题:
(1)A在周期表中的位置是 ,写出一种工业制备单质F的离子方程式 。
(2)B、D、E组成的一种盐中,E的质量分数为43%,其俗名为 ,其水溶液与F单质反应的化学方程式为 ;在产物中加入少量KI,反应后加人CC14并振荡,有机层显 色。
(3)由这些元素组成的物质,其组成和结构信息如下表:
| 物质 |
组成和结构信息 |
| a |
含有A的二元离子化合物 |
| b |
含有非极性共价键的二元离子化合物,且原子数之比为1:1 |
| c |
化学组成为BDF2 |
| d |
只存在一种类型作用力且可导电的单质晶体 |
a的化学式为 ;b的化学式为 ;c的电子式为 ;
d的晶体类型是 。
(4)由A和B、D元素组成的两种二元化合物形成一类新能源物质。一种化合物分子通过 键构成具有空腔的固体;另一种化合物(沼气的主要成分)分子进入该空腔,其分子的空间结构为 。
(8分)根据下边的实验装置图回答下列问题。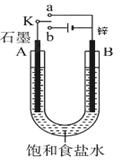
(1)若开始时开关K与a连接,则B极的电极反应式为;
(2)若开始时开关K与b连接,则B极的电极反应式为;
总反应的化学方程式为;
有关上述实验,下列说法正确的是(填序号)。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(8分,改编)某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。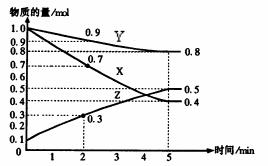
(1)由图中的数据分析,该反应的化学方程式为 ;
(2)反应开始至5min时Z的平均反应速率为 ;
(3)5min后,Z的生成速率比Z的消耗速率 (填“大”、“小”或“相等”),原因是
、
石油化工专家闵恩泽院士获2007年度国家最高科学技术奖,他是石油化工技术自主创新的先行者和绿色化学的开拓者,他研制的多种石油炼制催化剂极大地降低了我国石油化工产品的成本。
(1)使用催化剂进行石油裂化及裂解获得的主要产品是。
(2)“绿色化学工艺”的理想状态是反应物中原子利用率为100%。工业上,通过绿色化学工艺用CO、CH3OH和一种不饱和脂肪链烃合成CH2=C(CH3)COOCH3,该不饱和脂肪链烃的分子式为。
(3)下图表示石油炼制中某一反应进行过程中能量(单位为kJ/mol)的变化示意图。则石油炼制中的该反应属于反应(填“放热”或“吸热”)。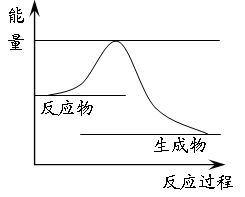
(4)科研人员在实验室中按下列流程在催化反应器中装载不同的催化剂,探究不同催化剂对石油裂解反应的催化性能。
①该探究实验的检测装置中选择的检测试剂是。
②从安全的角度考虑,本实验尾气处理的方法是。
已知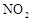 和
和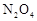 可以相互转化:
可以相互转化: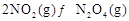 △H<0。现将一定量
△H<0。现将一定量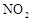 和
和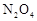 的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。
的混合气体通入一个体积为2L的恒温密闭玻璃容器中,反应物浓度随时间变化关系如图。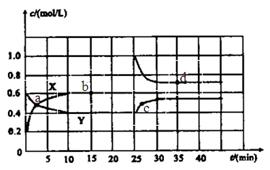
(1)图中共有两条曲线X和Y,其中曲线________表示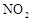 浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收
浓度随时间的变化;若在实现X、Y两条曲线变化过程中,共吸收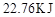 的热量,则该反应的热化学方程式为__________。
的热量,则该反应的热化学方程式为__________。
(2)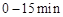 ,反应
,反应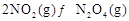 的平衡常数K(b)=__________;比较
的平衡常数K(b)=__________;比较 在
在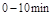 时平均反应速率
时平均反应速率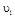 与
与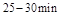 时平均反应速率
时平均反应速率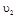 的大小__________。
的大小__________。
(3)反应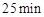 时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
时,若只改变了某一个条件,使曲线发生如上图所示的变化,该条件可能是________(用文字表达);其平衡常数K(d)_______K(b)(填“>”、“=”或“<”)。
(4)若要达到使 的体积百分含量与d点相同的化学平衡状态,在
的体积百分含量与d点相同的化学平衡状态,在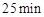 时还可以采取的措施是___________。
时还可以采取的措施是___________。
| A.加入催化剂 | B.缩小容器体积 | C.升高温度 | D.加入一定量的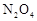 |
在298K、100kPa时,在1L水中可溶解0.09mol氯气,实验测得溶于水的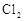 约有三分之一与水反应。请回答下列问题:
约有三分之一与水反应。请回答下列问题:
(1)该反应的离子方程式为______________________________________;
(2)估算该反应的平衡常数________________(列式计算,写明解题过程,否则不得分);
(3)在上述平衡体系中加入少量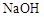 固体,平衡将向________移动;
固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”“减少”或“不变”),平衡将向_________移动。
(5)氯气溶于水达到饱和后,若其他条件不变,只改变某一条件,下列叙述正确的是
A.再通入少量氯气,c(H+)/c( )减小 )减小 |
| B.通入少量HCl,溶液漂白性增强 |
C.加入少量固体NaOH,一定有c(Na+)=c(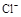 )+c( )+c( ) ) |
| D.加入少量CaCO3,溶液漂白性增强 |