设NA为阿伏伽德罗常数的值。下列叙述正确的是
| A.20mL 10mol·L-1的浓硝酸或浓硫酸与足量铜加热反应转移电子数均为0.2NA |
| B.0.1mol的白磷(P4)或甲烷中所含的共价键数均为0.4NA |
| C.在精炼铜或电镀铜的过程中,当阴极析出铜32g转移电子数均为NA |
| D.标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA |
下列关于硫酸工业生产过程的叙述错误的是
| A.在接触室中使用铁粉作催化剂 |
| B.在接触室中运用热交换技术可充分利用能源 |
| C.把硫铁磨成细粉末,可以提高原料的利用率 |
| D.该反应采用450~500℃主要是因为该温度下催化剂活性好 |
下列陈述正确并且有因果关系的是
| 选项 |
陈述Ⅰ |
陈述Ⅱ |
| A |
SO2有漂白性 |
SO2可使溴水褪色 |
| B |
SiO2有导电性 |
SiO2可用于制备光导纤维 |
| C |
浓硫酸有强氧化性 |
浓硫酸可用于干燥H2和CO |
| D |
Fe3+有强氧化性 |
FeCl3溶液可用于回收废旧电路板中的铜 |
将足量X气体通入Y溶液中,实验结果与预测的现象一致的组合是
| A.只有①②③ | B.只有①②④ |
| C.只有①③④ | D.①②③④ |
碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是()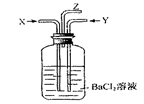
A.洗气瓶中产生的沉淀是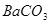 |
B.在Z导管出来的气体中无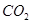 |
C.洗气瓶中产生的沉淀是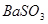 |
| D.在Z导管口有红棕色气体出现 |
某研究性学习小组做铜与浓硫酸反应实验时,发现试管底部有白色固体甲并夹杂有少量黑色物质乙。倒去试管中的浓硫酸,将剩余固体(含少量浓硫酸)倒入盛有少量水的烧杯中,发现所得溶液为蓝色,仍有未溶解的黑色固体丙。过滤、洗涤后,向黑色固体丙中加入过量浓硝酸,黑色固体溶解,溶液呈蓝色,所得溶液加BaCl2溶液后有白色沉淀生成。下列所得结论不正确的是
| A.铜与浓硫酸反应所得白色固体甲是CuSO4 |
| B.加BaCl2溶液后所得白色沉淀是BaSO3 |
| C.白色固体甲中夹杂的少量黑色物质乙中可能含有CuO |
| D.白色固体甲中夹杂的少量黑色物质乙中含元素Cu、S |