物质的类别和核心元素的化合价是研究物质性质的两个基本视角。
(1)图中X的电子式为 ;其水溶液长期在空气中放置容易变浑浊,该变化体现出:S非金属性比O (填“强”或“弱”)。用原子结构解释原因:同主族元素最外层电子数相同,从上到下, ,得电子能力逐渐减弱。
(2)Na2S2O3是一种用途广泛的钠盐。
①下列物质用于Na2S2O3的制备,从氧化还原反应的角度,理论上有可能的是______(填字母序号)。
a. Na2S+ S b. Z+ S c. Na2SO3 + Y d. NaHS + NaHSO3
②已知反应:Na2S2O3 + H2SO4 ="=" Na2SO4 + S↓+SO2↑+H2O。研究其反应速率时,下列说法正确的是 (填写字母序号)。
a.可通过测定一段时间内生成SO2的体积,得出该反应的速率
b.可通过比较出现浑浊的时间,研究浓度、温度等因素对该反应速率的影响
c.可通过Na2S2O3固体与稀硫酸和浓硫酸的反应,研究浓度对该反应速率的影响
(3)治理含CO、SO2的烟道气,可以将其在催化剂作用下转化为单质S和无毒的气体。
已知:①CO(g)+ 1/2 O2(g)=CO2(g) △H=-283 kJ·mol-1
②S(s)+ O2(g)=SO2(g) △H=-296 kJ·mol-1
①则治理烟道气反应的热化学方程式为 。
②一定条件下,将CO与SO2以体积比为4∶1置于恒容密闭容器中发生上述反应,下列选项能说明反应达到平衡状态的是 (填写字母序号)。
a.v (CO) ∶v(SO2) = 2∶1
b.平衡常数不变
c.气体密度不变
d.CO2和SO2的体积比保持不变
测得上述反应达平衡时,混合气体中CO的体积分数为 ,则SO2的转化率为 。
,则SO2的转化率为 。
(1)(NH4)2SO4在强热条件下,可分解生成NH3、SO2、N2、H2O.
反应中氧化产物和还原产物的物质的量之比为。
(2)将K2S跟HNO3反应,生成NO、S、KNO3、H2O,反应的化学方程式为;氧化产物是;若生成2molNO,反应中电子转移的总物质的量为mol。
(1)浓H2SO4能够用于干燥某些气体,是由于它具有性;下列气体能用浓硫酸来进行干燥的气体是(可多选,但只要有选错项,即得0分)① Cl2② H2S③ NH3④ CO2
(2)浓H2SO4能使纸片变黑,是由于它具有性;
(3)浓H2SO4可以与Cu反应,是由于它具有 性和性,其反应的化学方程式是: 。
纯碱是一种重要的化工原料。目前制碱工业主要有"氨碱法"和"联合制碱法"两种工艺。请按要求回答问题:
(1)"氨碱法"产生大量
废弃物,请写出该工艺中产生
的化学方程式:;
(2)写出"联合制碱法"有关反应的化学方程式:
(3)
是制碱工业的重要原料,"联合制碱法"与"氨碱法"中
的来源有何不同?
;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据"联合制碱法"总反应,列出计算原子利用率的表达式:原子利用率(%)=
根据图示回答下列问题: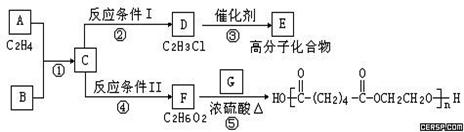
(1)写出A、E、G的结构简式:A,E,G;
(2)反应②的化学方程式(包括反应条件)是,反应④化学方程式(包括反应条件)是;
(3)写出①、⑤的反应类型:①、⑤。
下表是稀硫酸与某金属反应的实验数据:
| 实验序号 |
金属 质量/g |
金属状态 |
(
) |
(
) / |
溶液温度/℃ |
金属消失的时间/ | |
| 反应前 |
反应后 |
||||||
| 1 |
0.10 |
丝 |
0.5 |
50 |
20 |
34 |
500 |
| 2 |
0.10 |
粉末 |
0.5 |
50 |
20 |
35 |
50 |
| 3 |
0.10 |
丝 |
0.7 |
50 |
20 |
36 |
250 |
| 4 |
0.10 |
丝 |
0.8 |
50 |
20 |
35 |
200 |
| 5 |
0.10 |
粉末 |
0.8 |
50 |
20 |
36 |
25 |
| 6 |
0.10 |
丝 |
1.0 |
50 |
20 |
35 |
125 |
| 7 |
0.10 |
丝 |
1.0 |
50 |
35 |
50 |
50 |
| 8 |
0.10 |
丝 |
1.1 |
50 |
20 |
34 |
100 |
| 9 |
0.10 |
丝 |
1.1 |
50 |
20 |
44 |
40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,对反应速率有影响,反应速率越快,能表明同一规律的实验还有(填实验序号);
(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);
(3)本实验中影响反应速率的其他因素还有,其实验序号是。
(4)实验中的所有反应,反应前后溶液的温度变化值(约15℃)相近,推测其原因: