向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g),已知:平均反应速率vC=
pC(g)+qD(g),已知:平均反应速率vC= vA;反应2 min时,A的物质的量减少了
vA;反应2 min时,A的物质的量减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成。回答下列问题:
mol,有a mol D生成。回答下列问题:
(1)反应2 min内,vA=_____mol/(L·min);
(2)化学方程式中,x:y:p:q= ;
(3)反应平衡时,D为2a mol,则B的转化率为________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5 a mol,则该反应的ΔH________0;(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率_____,(填“增大”、“减小”或“不变”)理由是 ;
②平衡时反应物的转化率________,(填“增大”、“减小”或“不变”)
理由是 。
化学能的转化在现实生活中得到了广泛的利用。回答以下问题:
(Ⅰ)(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55 kJ的热量,写出表示甲烷燃烧的热化学方程式:。
(2)2Zn(s)+O2(g)=2ZnO(s) ΔH1=" —702" kJ/mol
2Hg(l)+O2(g)=2HgO(s) ΔH2=" —182" kJ/mol
由此可知ZnO(s)+Hg(l)= Zn(s)+HgO(s)△H3=。
(3)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。下图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式: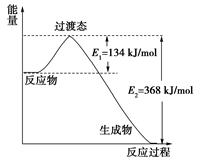
(Ⅱ)下图为相互串联的甲乙两个电解池: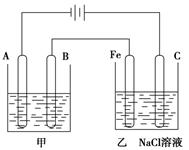
请回答:
(1)甲池若为用电解原理精炼铜的装置,则:
A极是 极,材料是,电极反应为 ,
B极是 极,材料是,电极反应为 ,
电解质溶液为 。
(2)乙池中若滴入少量酚酞试液,开始一段时间后,Fe极附近呈 色。
(3)若甲槽阴极增重12.8g,则乙槽阳极放出气体在标准状况下的体积
_________________。
(4)同时若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为
__ _____。
利用化学反应原理研究生产、生活中的实际问题具有十分重要的意义:
(Ⅰ)氮气和氢气合成氨是化学工业中极为重要的反应,其热化学方程式可表示为:N2(g)+3H2(g)  2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
2NH3(g) ΔH=-92 kJ·mol-1。请回答下列问题:
(1)取1 mol N2(g)和3 mol H2(g)放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量_____92 kJ(填“大于”“等于”或“小于”),原因是_______;若加入催化剂,ΔH (填“变大”“变小”或“不变”)。
(2)已知:分别破坏1 mol N≡N键、1 mol H—H键需要吸收的能量为:946 kJ、436 kJ,则破坏1 mol N—H键需要吸收的能量为______kJ。
(3)N2H4可视为:NH3分子中的H被—NH2取代的产物。发射卫星用N2H4(g)为燃料,NO2为氧化剂生成N2和H2O(g)。
已知:N2(g)+2O2(g)===2NO2(g)ΔH1=+67.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g)ΔH2=-534 kJ·mol-1。
则:1 mol N2H4完全反应的热化学方程式为。
(Ⅱ)某铅蓄电池的正、负极标记被磨损。试用下图装置设计实验,识别出此铅蓄电池的正负极。
(1)若A接E,B接F,而B电极出现,反应式为,则说明F为正极;
(2)若铅蓄电池工作时(放电),其E所在电极的电极反应式为:,充电时该极与外加电源的极相连。
(3)若用该电池电解Cu(NO3)2 溶液,其电解方程式为
若有0.2mol电子发生转移,则正极消耗的PbO2的物质的量是;要想CuSO4溶液恢复原样,需加入的物质是,质量为
按下图装置进行实验,已知C1、C2为石墨棒。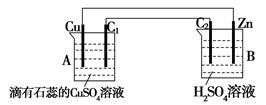
回答下列问题:
(1)判断装置的名称:A池为_______,B池为________;
(2)锌极为_____极,电极反应式为______________;
铜极为_____极,电极反应式为______________;
石墨棒C1为___极,电极反应式为______________;
石墨棒C1附近发生的实验现象为________________。
(3)当C1极析出224mL气体(标准状况下)时,锌的质量____(填“增加”、“不变”或“减少”)了_____g,CuSO4溶液的质量____(填“增加”、“不变”或“减少”)_____g。
今有一澄清溶液,只可能含有下表中的若干种离子(存在的离子均大量):
| 阳离子 |
K+、NH4+、H+、Ba2+ |
| 阴离子 |
Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
(1)100 mL溶液中c(SO42-)=_____________________。
(2)第二份加入NaOH溶液产生气体的离子方程式_____________________
(3)6.27 g沉淀的成分是_____________________ (用化学式表示)。
(4)上述澄清溶液中除SO42-以外,一定大量存在的离子是_____________________
室温下,0.1mol/L的醋酸溶液的PH约为3,当向其中加入醋酸钠晶体溶解后发现溶液的PH变大,对上述现象有两种不同的解释:甲同学认为醋酸钠水解呈碱性,c(OH-)增大,因而溶液的PH增大;乙同学认为醋酸钠溶于水电离出大量的醋酸根离子,抑制了醋酸的电离,使c(H+)减小,因此溶液的PH增大。
(1)上述解释中(填“甲”或“乙”)正确。
(2)为验证上述哪种解释正确,继续做如下实验:向0.1mol/L醋酸中加入少量下列物质中的_____,然后测定溶液的PH值。
| A.固体CH3COOK | B.固体CH3COONH4 | C.NH3气体 | D.固体NaHCO3 |
(3) 若_____(填“甲”或“乙”)的解释正确,溶液的PH应_____(填“增大”、“减小”或“不变”)
(4)常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有种粒子
②溶液中有两种粒子的物质的量之和一定等于0.01mol,它们是和
③溶液中n(CH3COO-)+ n(OH-)-n(H+)=