X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A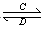 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
X、Y 、Z、W为原子序数依次增大的四种短周期主族元素,其中X、Z同族,W、Z同周期, Y是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,W的最高正价与最低负价代数和为6。
、Z、W为原子序数依次增大的四种短周期主族元素,其中X、Z同族,W、Z同周期, Y是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,W的最高正价与最低负价代数和为6。
(1)X元素的名称是。该元素在周期表中的位置为
(2)Y元素符号是 Y元素的原子结构示意图为
Y元素的原子结构示意图为
(3)X、Y、Z三种元素按原子半径由大到小的顺序排列为(用元素符号填空)
(4)X、Y、Z、W四种元素的最高价氧化物对应的水化物酸性最强的是
碱性最强的是(用化学式填空)
(5)写出Y元素的最高价氧化物对应的水化物和W元素的最高价氧化物对应的水化物反应的离子方程式
将19.2g的铜和某浓度的硝酸反应,生成8.96L(标况)的气体,则参加反应的硝酸为moL,将这8.96L的气体和标况下L的氧气混合,再通入水中没有气体剩余。
(6分)A、B、C、D、E五种微粒具有相同的电子数,它们之间能发生如下反应:
A+B=C+D;如果将B、D、E 混合B少量则有白色沉淀,B过量则无沉淀,请回答:
(1)用化学符号表示下列4种微粒: A:B:C:D:
A:B:C:D:
(2)写出B、D、E 混合B过量时的离子方程式:
某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色:J分子内有两个互为对位的取代基。在一定 条件下有如下的转化关系:(无机物略去)
条件下有如下的转化关系:(无机物略去)
(1)A物质的结构简式为:________________。写出三种属于芳香烃类的A的同分异构体______________________、______________________、______________________。
(不包括A,写结构简式)
(2)J中所含的含氧官能团的名称为_____________________________________。
(3)E与H反应的化学方程式是__________________________;反应类型是__________。
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是_______________。
(5)已知J有多种同分异构体,写出一 种符合下列性质的J的同分异构体的结构简式。
种符合下列性质的J的同分异构体的结构简式。
①与FeCl3溶液作用显紫色; ②与新制Cu(OH)2悬浊液作用产生红色沉淀;③苯环上的一卤代物有2种。________________________________________
有机物A的结构简式为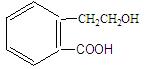 ,它可通过不同化学反应分别制得B、C、D和E四种物质。
,它可通过不同化学反应分别制得B、C、D和E四种物质。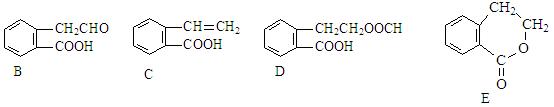
请回答下列问题:
(1)在A-E五种物质中,互为同分异构体的是(填代号)。
(2)写出由A生成B的化学方程式和反应类型,反应类型:。
(3)C能形成高聚物,该高聚物的结构简式为。
(4)写出D与NaOH溶液共热反应的化学方程式。