2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g) 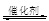 2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2 (g) +N2 (g)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。 据此判断:
据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右
图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g) 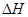 =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g) 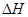 =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。下图是通过光电转化原理以廉价原料制备新产品的示意图。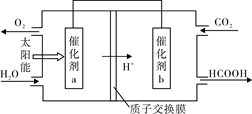
写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a)。
从明矾中提取K2SO4和Al2(SO4)3的主要操作有下列四步,下面是对每步操作提出的问题,请完成填空:
(1)将固体明矾用水溶解,加入过量的氨水,并过滤、洗涤沉淀。加过量氨水的目的是 ,
洗涤沉淀的目的是 。
(2)取沉淀加 直到沉淀完全溶解,再蒸发、结晶得 。
(3)取(1)的滤液,加稍过量的 溶液并加热,其目的是
;
再加入少量 中和多余的碱。
(4)对(3)所得的溶液加热、浓缩、结晶得 。
某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的一种或几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
(1)溶液中一定含有的溶质是 ,一定不含有的溶质是 (填化学式)。
(2)溶液中可能含有的溶质是 (填名称),判断该物质是否存在的实验方法是 ,现象是 。
(3)分别写出AB段、BC段发生反应的离子方程式:
①AB段为 ;
②BC段为 。
下图所示是从铝土矿(主要成分是Al2O3,含Fe2O3、SiO2等杂质)中提取氧化铝的工艺流程之一。
已知:SiO2能和氢氧化钠反应,不和盐酸反应。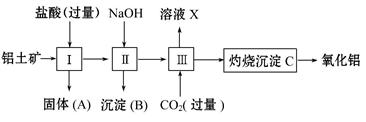
回答下列问题:
(1)用盐酸溶解铝土矿后,所得溶液中的阳离子有 。
(2)固体A的主要成分是 。
(3)进行操作Ⅱ时,为了达到分离要求,加入的NaOH应该 。
(4)进行操作Ⅲ时,一般通入过量CO2,其反应的化学方程式是
。
(5)溶液X和盐酸反应的离子方程式为
。
含镁3%~5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为m1g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:
镁铝合金 溶液
溶液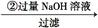 得到沉淀的质量为m2g;
得到沉淀的质量为m2g;
实验设计2:
镁铝合金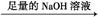 生成的气体在标准状况下的体积为V1L。
生成的气体在标准状况下的体积为V1L。
实验设计3:
镁铝合金 生成的气体在标准状况下的体积为V2L。
生成的气体在标准状况下的体积为V2L。
请回答以下问题:
(1)写出实验设计1中单质铝在第①步中发生反应的离子方程式:
。
(2)写出实验设计2中反应的离子方程式: 。
(3)判断这几种实验设计能否求出镁的质量分数,能求出的用题目提供的数据将镁的质量分数表示出来,不能求出的就空着不填。
①实验设计1: 。
②实验设计2: 。
③实验设计3: 。
某无色溶液中只含有下列8种离子中的某几种:Mg2+、H+、Ag+、Na+、Cl-、HC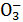 、OH-、N
、OH-、N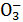 ,已知该溶液能与铝反应放出氢气。试回答下列问题:
,已知该溶液能与铝反应放出氢气。试回答下列问题:
(1)若反应后生成Al3+,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
(2)若反应后生成Al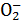 ,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。
,则溶液中可能存在的离子有 ,一定存在的离子有 ,一定不存在的离子有 ,反应的离子方程式为 。