合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g) 2NH3(g) ∆H=—92.4kJ•mol‾1
2NH3(g) ∆H=—92.4kJ•mol‾1
一种工业合成氨的简易流程图如下:

(1)天然气中的H2S杂质常用常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式: 。
(2)步骤II中制氯气原理如下:

对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的是 。
a.升高温度 b.增大水蒸气浓度 c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若1mol CO和H2的混合气体(CO的体积分数为20%)与H2O反应,得到1.18mol CO、CO2和H2的混合气体,则CO转化率为 。
(3)下左图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数: 。
(4)依据温度对合成氨反应的影响,在下右图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

(5)上述流程图中,使合成氨放出的热量得到充分利用的主要步骤是(填序号) ,简述本流程中提高合成氨原料总转化率的方法: 。
利用氧化还原反应原理配平
⑴ NH3 + O2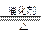 NO + H2O
NO + H2O
⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
浓硫酸在下列用途和现象中所表现的性质是
| A.沸点高、难挥发 | B.酸性 | C.吸水性 | D.脱水性 E.强氧化性 |
| 用途或现象 |
体现浓硫酸的性质 |
( 1)浓硫酸使胆矾变成白色 1)浓硫酸使胆矾变成白色 |
|
| (2)浓硫酸使蔗糖变”黑面包” |
|
| (3)浓硫酸与铜片共热 |
|
| (4)浓硫酸的木炭共热产生气体 |
(16分) 373 K时,某1 L密闭容器中加入1molPCl5发生如下可逆反应: PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
PCl5 (g) PCl3(g) + Cl2 (g)。其中物质PCl3的物质的量变化如图所示。
(1)前20 s内PCl5(g)的平均反应速率为
(2)373 K时该反应的平衡常数的值为
(3)若在此平衡体系中再加入1mol的PCl5,与原平衡比较,新平衡时PCl5的转化率(填“增大”或“减小”,下同)。PCl5的平衡浓度
(4)将原平衡升温至473 K,重新达平衡时(其他条件不变),PCl3的平衡浓度为PCl5的3倍,该反应的正反应为(填“放热反应”或 “吸热反应”),为增大平衡体系中Cl2的物质的量,下列措施正确的是(其它条件相同)
a.升高温度 b.扩大容器的体积
c.加入合适的催化剂 d.再充入PCl3
从某些植物树叶提取的挥发油中含有下列主要成分:
(1)有关A、B、C三种物质的说法正确的是(填序号)
a.均能发生加聚反应 b.只有B能与FeCl3发生显色反应
c.均不能与碳酸钠溶液反应 d.只有C能发生银镜反应
(2)A中苯环上的一卤代物的同分异构体的数目为种。
(3)0.5molB与足量的溴水充分反应,消耗mol单质溴。
(4)写出C与Cu(OH)2在加热条件下发生反应的化学方程式
。
(5)写出A在一定条件下生成高分子化合物的结构简式:
。
阻垢剂可防止工业用水过程中无机物沉积结垢,经由下列反应路线可得到E和R两种阻垢剂(部分反应条件略去).
(1)阻垢剂E的制备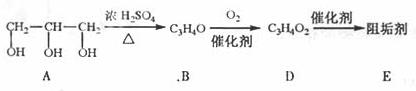
①A可由人类重要的营养物质________水解制得(填“糖类”、“油脂”或“蛋白质”).
②B与新制的Cu(OH)2反应生成D,其化学方程式为____________。
③D经加聚反应生成E,E的结构简式为____________。
(2)阻垢剂R的制备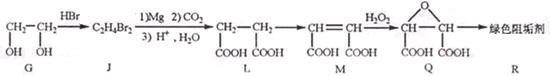
①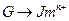
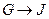 为取代反应,J的结构简式为____________。
为取代反应,J的结构简式为____________。
②J转化为L的过程中,L分子中增加的碳原子来源于____________。
③由L制备M的反应步骤依次为: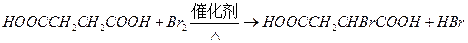 、____________、____________ (用化学方程式表示)
、____________、____________ (用化学方程式表示)
④1 molQ的同分异构体T(碳链无支链)与足量NaHCO3溶液作用产生2molCO2,T的结构简式为____________(只写一 种)。
种)。