(共10分)某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案 。
(2)学生乙在实验中取了一段黑色的镁带,投入稀盐酸中,现象不十分明显,请分析原因 。
(3)学生丙另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法?
(Ⅱ)学生丁设计了下图装置以验证氮、碳、硅元素的非金属性强弱。他设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
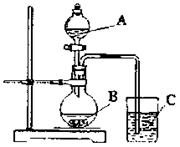
(1)A写出所选用物质的化学式:
A: ,
B: 。
(2)写出烧杯中发生反应的离子方程式: 。
(1-5班必做题)实验室制得的乙炔中常混有H2S、PH3等杂质气体。如图是两学生设计的实验装置,用来测定电石样品中CaC2的纯度,右边的反应装置相同而左边的气体发生装置则不同,分别如Ⅰ和Ⅱ所示。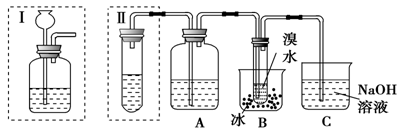
(1)A瓶中的液体可以从酸性KMnO4溶液和CuSO4溶液中选择,应该选择________,它的作用是__。
(2)写出实验室制取乙炔的化学方程式。
(3)装置Ⅰ的主要缺点是_______________。装置Ⅱ的主要缺点是___________________;
若选用Ⅱ装置来完成实验,则应采取的措施是__________________。
(4)若称取m g 电石,反应完全后,测得B处溴水增重n g,则CaC2的纯度为________。
(1-5班必做题)某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如下实验装置,请回答下列问题:
(1)A试管中发生反应的离子方程式。
(2)B试管中的现象是。
(3)该实验设计不严密,请你改正。
苯甲酸和苯甲酸钠均是食品防腐剂。某化学学习小组的同学们尝试用甲苯的氧化反应制备苯甲酸,实验过程如下:按图示装置,在圆底烧瓶中放入适量甲苯和水,在石棉网上加热至沸,从仪器X上口加入适量高锰酸钾,继续煮沸并间歇摇动烧瓶,直到甲苯层消失,回流液不再出现油珠时停止反应。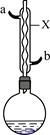
按如下流程分离出苯甲酸:
已知:① 苯甲酸熔点为122 ℃,沸点为249 ℃。
② 不同温度下苯甲酸在水中溶解度:4 ℃—0.18 g,18 ℃—0.27 g,75 ℃—2.2 g;
③
请回答下列问题:
(1)仪器X的名称是,冷却水应从口进入(填“a”或“b”)。
(2)分离苯甲酸的操作中,冰水浴冷却滤液的主要目的是,制得的苯甲酸晶体中可能含有的杂质是,为进一步提纯,应采用的方法是。
(3)芳香化合物A与苯甲酸分子式相同,A与NaOH溶液反应生成两种盐,该反应的化学方程式是。
某课外小组同学设计了如图所示装置(夹持、加热仪器省略)进行系列实验。请根据下列实验回答问题: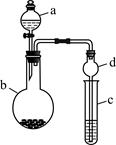
(1)甲同学用此装置验证物质的氧化性:KMnO4>Cl2>Br2,则a中加浓盐酸,b中加KMnO4,c中加_______溶液。将浓盐酸滴入b中后,发生反应的化学方程式是;b中反应结束后再向c中加入少量CCl4,振荡静置后观察到c中的现象为________。
(2)乙同学用此装置制少量溴苯,a中盛液溴,b中为铁屑和苯,c中盛水。将液溴滴入b中后,发生反应的化学方程式是:_________,。向c中滴加AgNO3溶液,可观察到的现象是____________。
(3)丙同学用上述装置制乙酸乙酯,a中加浓硫酸,b中盛装乙醇和乙酸。将浓硫酸滴入b中后用酒精灯对b缓慢加热,b中发生反应的化学方程式是;c中应盛装______溶液,其作用是______________________。
以锌铜合金的废料为原料制备硫酸铜晶体(CuSO4·5H2O)的部分工艺流程如图所示: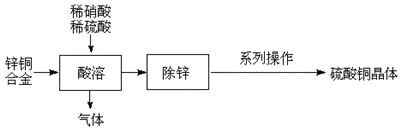
(1)酸溶时,铜转化为Cu2+的离子方程式为 ,锌铜合金要剪成碎片且反应过程要不断搅拌,其目的是 。
(2)为使酸溶后的溶液中不含NO3-,配制混酸稀溶液时,应控制硫酸与硝酸的物质的量之比不小于 。
(3)“系列操作”为 、 、过滤、洗涤、干燥。
(4)测定除锌后的溶液中Cu2+离子浓度的方法为:准确量取V1mL除锌后的溶液于锥形瓶中,调节pH=3~4,加入过量KI,充分反应后,滴加2滴淀粉溶液,再慢慢滴加c mol/L Na2S2O3标准溶液至恰好完全反应,消耗Na2S2O3标准溶液V2 mL。已知: 2Cu2++4I-=2CuI↓+I2 2S2O32-+I2=S4O62-+2I-
①“恰好反应”时溶液的颜色变化为 。
②Cu2+离子的物质的量浓度为 mol/L(用V1、V2、c表示)。
③若除锌后的溶液中仍含有NO3-离子,则测定结果会 (填“偏大”、“偏小”、“无影响”)。