(10分)(1)维生素A的结构简式如下:
1 mol维生素A最多可与______mol H2发生加成反应。维生素A________(填“属于”或“不属于”)芳香化合物。
(2)在有机反应中,反应物相同而条件不同,可得到不同的主产物,下式中R代表烃基,副产物均已略去。
(Ⅰ)
(请注意H和Br加成的位置)
(Ⅱ)
请写出实现下列转变的各步反应的化学方程式,写明反应条件。
①由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3:_________________________________;
②由(CH3)2CHCH===CH2分两步转变为(CH3)2CHCH2CH2OH:______________________________。
(8分)甲、乙、丙三种物质之间有如下转化关系: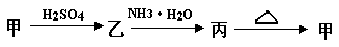
(1)若甲是不溶于水的白色固体物质,既能溶于盐酸又能溶于氢氧化钠溶液,则甲是____________;写出 乙→丙转化的化学方程式___________________________。
(2)若乙溶液中加入KSCN溶液,有红色出现,则甲物质是__________________________;
写出甲→乙转化的离子方程式_______________________________________。
(8分)下列各反应中,通入的气体反应物各起什么作用?请选择下列序号填空:
| A.只做氧化剂 | B.只做还原剂 |
| C.既做氧化剂又做还原剂 | D.既不做氧化剂又不做还原剂 |
(1)氯气通入水中:Cl2+H2O===HCl+HClO______________________
(2)二氧化氮通入水中:3NO2+H2O===2HNO3+NO__________________
(3)二氧化碳气体通入氢氧化钾溶液中:CO2+2KOH===K2CO3+H2O____________
(4)二氧化硫气体通入氢硫酸中:SO2+2H2S="==3S↓" +2H2O_____________________
(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
(1)甲装置的名称是_____(填“原电池”或“电解池”)。
(2)写出电极反应式:Pt极;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_______(填“变深”、“变浅”或“无变化”)。
(4)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为。(用NA表示)
(Ⅱ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。
(1)欲使铁制品表面镀铜,应以_______为阳极,电解质溶液为。
(2)以铂作阳极电解溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为。
(16分)Ⅰ.用中和滴定法测定某烧碱样品的纯度。(锥形瓶中装待测液)配制待测液:将2.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制200mL溶液。
(1)滴定:盛装0.20mol/L盐酸标准液应该用酸式滴定管;滴定时,先向盛待测液的锥形瓶中加酚酞作为指示剂;滴定终点的现象是:_____________________________
(2)有关数据记录如下:
| 滴定序号 |
待测液体积(ml) |
所消耗盐酸标准液的体积(ml) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.55 |
| 2 |
20.00 |
6.00 |
25.95 |
纯度计算:烧碱样品的纯度为________________。
(3)对几种假定情况的讨论:(填无影响、偏高、偏低)(测定的结果指烧碱溶液的浓度)
①若用蒸馏水冲洗锥形瓶,则会使测定的结果___________________
②若滴定前用蒸馏水冲洗酸式滴定管后即装标准盐酸,则会使测定结果__________
③滴加盐酸时未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果________。
Ⅱ.现有室温下浓度均为1×10-3 mol/L的几种溶液:①盐酸、②硫酸、③醋酸、④NaOH溶液,回答下列问题:
(1)将③、④混合后,若溶液呈中性,则消耗两溶液的体积为③________④(填“>”、“<”或“=”)。溶液中的离子浓度由大到小的顺序为________________。
(2)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的顺序为___________,(填序号)最终产生H2总量的关系为___________(填序号)
(3)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH大小关系为①_________③(填“>”、“<”或“=”)
(12分)(1)物质的量浓度相同的三种盐NX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是。
(2)比较下列溶液的pH(填“>”“<”或“=”):
①0.1 mol·L-1Na2CO3溶液0.1 mol·L-1NaHCO3溶液
②0.1 mol·L-1NH4Cl溶液0.01 mol·L-1NH4C1溶液
(3)把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连,可以组成各种原电池。若a、b相连,a为负极;c、d相连,c极发生氧化反应;a、c相连,c为正极;b、c相连,电流由c极流向b极,则这四种金属的活动性由强到弱的顺序为。
(4)将AlCl3溶液蒸干、灼烧,最后所得的固体的主要成份是。
(5)氯化铁溶液呈性(填“酸”、“碱”或“中”),原因是(用离子方程式表示):
(6)向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-刚好沉淀完全时,溶液的pH7(填“>”“<”或“=”),离子反应总方程式为:。