钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。

②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
[化学——选修2:化学与技术]水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康。请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl-和SO42-。则该硬水属于________(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加________后加________。
(2)我国规定饮用水的硬度不能超过25度。硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10 mg CaO称为1度。某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT-(铬黑T)===MEBT+
蓝色酒红色
M2+(金属离子)+Y4-(EDTA)===MY2-
MEBT++Y4-(EDTA)===MY2-+EBT-(铬黑T)
实验过程:
①取地下水样品25.00 mL进行预处理。写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________________________________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是_______________________。
③将处理后的水样转移到250 mL的锥形瓶中,加入氨水—氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00 mol·L-1的EDTA标准溶液进行滴定。滴定终点时共消耗EDTA溶液15.00 mL,则该地下水的硬度为______________。
(3)某工业废水中含有CN-和Cr2O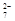 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理: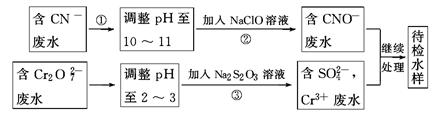
回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为_______。
②含Cr3+废水需进一步处理,请你设计一个处理方案:_______。
(15分)重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理: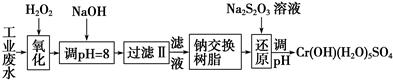
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Al(OH)3 |
Cr(OH)3 |
| pH |
3.7 |
9.6 |
11.1 |
8 |
9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2B.HNO3C.FeCl3D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+B.Al3+C.Ca2+D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O 的废水:
的废水:
该法用Fe作电极电解含Cr2O 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5 mol·L-1。
我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.
I.已知:2CO(g)+ O2(g)=2CO2(g),ΔH=-566 kJ·mol-1
2Fe(s)+  O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
O2(g)=Fe2O3(s),ΔH=-825.5 kJ·mol-1
反应:Fe2O3(s)+ 3CO(g)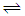 2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
2Fe(s)+ 3CO2(g),ΔH=______ kJ·mol-1.
Ⅱ.反应 Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)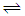
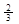 Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
Fe(s)+ CO2(g)在1000℃的平衡常数等于4。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=____________.
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________.
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
Ⅲ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:
CO(g)+ 2H2(g)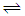 CH3OH(g).请根据图示回答下列问题:
CH3OH(g).请根据图示回答下列问题: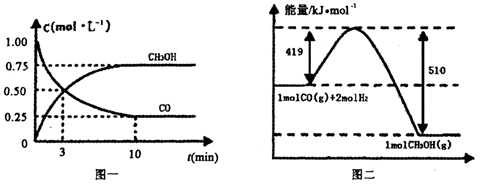
(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=________.
(2)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 |
反应物投入的量 |
反应物的转化率 |
CH3OH的浓度 |
能量变化(Q1、Q2、Q3均大于0) |
| 甲 |
1mol CO和2mol H2 |
α1 |
c1 |
放出Q1 kJ热量 |
| 乙 |
1mol CH3OH |
α2 |
c2 |
吸收Q2 kJ热量 |
| 丙 |
2mol CO和4mol H2 |
α3 |
c3 |
放出Q3 kJ热量 |
则下列关系正确的是________.
A.c1=c2
B.2Q1=Q3
C.2α1=α2
D.α1+α2 =1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量
(3)若在一体积可变的密闭容器中充入l mol CO、2mol H2和1mol CH3OH ,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向______(填“正”、“逆”)反应方向移动.
(4)甲醇可与氧气构成燃料电池,该电池用多孔的惰性电极浸入浓氢氧化钾溶液,写出该电池的负极反应式______________________。
【化学——选修2:化学与技术】研究化肥的合成、废水的处理等有现实的重要意义。
(1)硝酸铵的生产方法是采用硝酸与氨气化合,工业合成氨是一个放热反应,因此低温有利于提高原料的转化率,但实际生产中却采用400~500℃的高温,其原因是__________________;工业生产中,以氨气为原料合成硝酸,写出工业生产硝酸的最后一步的化学方程式________________________________。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同: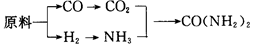
已知CO+H2O CO2+H2①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的
CO2+H2①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的
物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?_____________________。
(3)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等。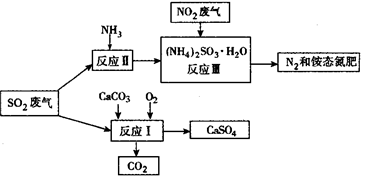
①写出反应Ⅰ的化学方程式:_________________________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________。
③检验经过反应Ⅲ得到的氨态氮肥中 所用试剂是_______________________。
所用试剂是_______________________。
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是____________________。
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_________________。
焦炭与CO、H2均是重要的能源,也是重要的化工原料。
(1)已知C、H2、CO的燃烧热(△H)分别为-393.5 kJ·mol-1、-285.8kJ·mol-1、-283 kJ·mol-1,又知水的气化热为+44 kJ/mol。
①焦炭与水蒸气反应生成CO、H2的热化学方程式为___________________。
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7 kJ时,则此时H2O(g)的转化率为_________________。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
①第一个平衡时段的平衡常数是______________,若反应进行到2 min时,改变了温度,使曲线发生如图所示的变化,则温度变化为___________(填“升温”或“降温”)。
②反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是下述中的____。
a.增加了C
b.增加了水蒸气
c.降低了温度
d.增加了压强
(3)假设(2)中反应在第2min时,将容器容积压缩至1 L,请在上图中绘制出能反映H2O、CO物质的量变化趋势的图像。
(4)若以CO、O2、K2CO3等构成的熔融盐电池为动力,电解400 mL饱和食盐水,则负极上的电极反应式为______________________,当有5·6g燃料被消耗时,电解池中溶液的pH=__________(忽略溶液的体积变化,不考虑能量的其它损耗)。