【化学——选修2:化学与技术】研究化肥的合成、废水的处理等有现实的重要意义。
(1)硝酸铵的生产方法是采用硝酸与氨气化合,工业合成氨是一个放热反应,因此低温有利于提高原料的转化率,但实际生产中却采用400~500℃的高温,其原因是__________________;工业生产中,以氨气为原料合成硝酸,写出工业生产硝酸的最后一步的化学方程式________________________________。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同: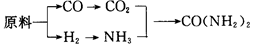
已知CO+H2O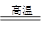 CO2+H2①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的
CO2+H2①甲厂以焦炭和水为原料;②乙厂以天然气和水为原料;③丙厂以石脑油(主要成分为C5H12)和水为原料。按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的
物质的量)和CO2的物质的量之比,则对原料的利用率最高。据此判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高?_____________________。
(3)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等。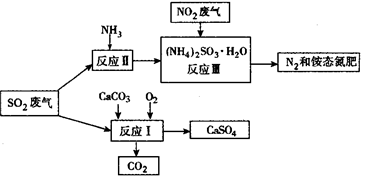
①写出反应Ⅰ的化学方程式:_________________________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________。
③检验经过反应Ⅲ得到的氨态氮肥中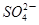 所用试剂是_______________________。
所用试剂是_______________________。
(4)工业上利用氯碱工业产品治理含二氧化硫的废气。下图是氯碱工业中电解饱和食盐水的原理示意图。
①用溶液A吸收含二氧化硫的废气,其反应的离子方程式是____________________。
②用含气体B的阳极区溶液吸收含二氧化硫的废气,其反应的离子方程式是_________________。
氮的重要化合物如氨(NH3)、肼(N2H4)、三氟化氮(NF3)等,在生产、生活中具有重要作用。
(1)利用NH3的还原性可消除氮氧化物的污染,相关热化学方程式如下:
H2O(l)=H2O(g) △H1=44.0 kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2=229.3 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3=-906.5 kJ·mol-1
4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H4
则△H4=kJ·mol-1。
(2)使用NaBH4为诱导剂,可使Co2+与肼在碱性条件下发生反应,制得高纯度纳米钴,该过程不产生有毒气体。
①写出该反应的离子方程式:。
②在纳米钴的催化作用下,肼可分解生成两种气体,其中一种能使湿润的红色石蕊试纸变蓝。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如下图1所示,则N2H4发生分解反应的化学方程式为:;为抑制肼的分解,可采取的合理措施有(任写一种)。
(3)在微电子工业中NF3常用作氮化硅的蚀刻剂,工业上通过电解含NH4F等的无水熔融物生产NF3,其电解原理如上图2所示。
①氮化硅的化学式为。
②a电极为电解池的(填“阴”或“阳”)极,写出该电极的电极反应式:;电解过程中还会生成少量氧化性极强的气体单质,该气体的分子式是。
将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4·5H2O)。
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是。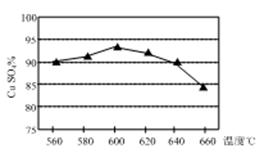
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。
①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm—3)的H2O2来配制,其具体配制方法是。
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步:。
第三步:,过滤。
第四步:、冷却结晶。
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为。
二氧化硫常用作消毒剂和漂白剂,也是一种重要的工业原料。
(1)将a mol SO2通入1 L 1 mol/L NaOH溶液中充分反应后,阴离子总数阳离子总数(填选项前的字母)。
A.a>1时大于B.a=1时等于C.大于D.小于
(2)保险粉(Na2S2O4)广泛用于印染行业和食品储存行业。可以将SO2通入草酸钠(Na2C2O4)和NaOH的混合溶液中制取保险粉。制取保险粉的离子方程式为。
(3)工业上常以SO2为原料制取Na2S2O3。步骤如下:
①将Na2S和Na2CO3按2︰1的物质的量之比配成混合溶液。
②将混合溶液注入敞口反应釜中,加热反应釜将温度控制在50℃左右。
③向反应釜中缓缓通入SO2至稍微过量使Na2S和Na2CO3完全反应。
④反应结束后加热浓缩溶液,冷却至30℃以下析出大量Na2S2O3晶体。
⑤滤出晶体,母液循环利用。
据此请回答:
(ⅰ)工业制取Na2S2O3的反应的化学方程式为。
(ⅱ)工业生产的首要目的是盈利,为节约成本并减少对环境的污染,应尽可能的提高产率,制取步骤中体现了这一思想的有(填步骤序号)。
(ⅲ)工业生产的Na2S2O3含有两种杂质,这两种杂质是Na2SO3和。以下条件中可以求出产品中Na2S2O3的物质的量分数的是。(填选项前的字母)
A.产品中钠原子和硫原子的物质的量之比
B.产品中钠原子和氧原子的物质的量之比
C.产品中硫原子和氧原子的物质的量之比
D.以上均能
(4)一种以铜作催化剂脱硫有如下两个过程:
①在铜的作用下完成工业尾气中SO2的部分催化氧化,所发生反应为:
2SO2+2n Cu+(n+1)O2+(2-2 n) H2O=2n CuSO4+(2-2n) H2SO4
每吸收标准状况下11.2 L SO2,被SO2还原的O2的质量为g。
②利用下图所示电化学装置吸收另一部分SO2,并完成Cu的再生。写出装置内所发生反应的离子方程式。
(14分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。
请回答下列问题。
(1)装置Ⅱ中NO在酸性条件下生成NO2—的离子方程式。
(2)含硫各微粒(H2SO3、HSO3—和SO32—)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。
①下列说法正确的是(填标号)。
| A.pH=7时,溶液中c( Na+)<c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH=2和 pH=9时的溶液中所含粒子种类不同 |
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在(填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是。
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。图中A为电源的(填“正”或“负”)极。右侧反应室中发生的主要电极反应式为。
(4)已知进入装置Ⅳ的溶液中NO2—的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO2—完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为L。
【化学选修2一化学与技术】下图是某企业设计的硫酸一磷肥一水泥联产、海水一淡水多用、盐一热一电联产的三大生态产业链流程图.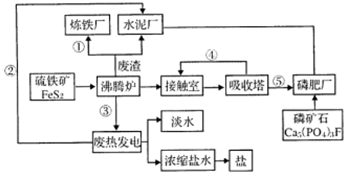
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:①、②____、③__、④、⑤
(2)沸腾炉发生反应的化学方程式:,磷肥厂的主要产艄是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙的化学方程式.
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸____吨.
(4)热电厂的冷却水是____,该流程中浓缔盐水除提取盐以外还可提取的物质有(写出一种即可).
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气和废渣的利用设想.(写出两点即可).