研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下放热反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g) K1 ∆H ="a" kJ/mol (I)
NaNO3(s)+ClNO(g) K1 ∆H ="a" kJ/mol (I)
2NO(g)+Cl2(g) 2ClNO(g) K2 ∆H ="b" kJ/mol (II)
2ClNO(g) K2 ∆H ="b" kJ/mol (II)
(1)反应4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示),∆H= kJ/mol(用a、b表示)。
(2)为研究不同条件对反应(II)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(II)达到平衡。测得10min内v(ClNO)=7.5×10-3mol•L-1•min-1,则平衡后
n(Cl2)= mol。其它条件保持不变,反应(II)在恒压条件下进行,平衡常数
K2 (填“增大”“减小”或“不变”)。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH=NaNO3+NaNO2+H2O。含0.2mol NaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.1mol•L‾1的CH3COONa溶液,则两溶液中c(NO3‾)、c(NO2-)和c(CH3COO‾)由大到小的顺序为 。(已知HNO2的电离常数Ka=7.1×10-4mol•L‾1,CH3COOH的电离常数K a=1.7×10-5mol•L‾1)
(4)由有机阳离子、Al2Cl7—和AlCl4—组成的离子液体作电解液时,可在钢制品上电镀铝。钢制品应接电源的 极,已知电镀过程中不产生其他离子且有机阳离子不参与电极反应,阴极电极反应式为 。若改用AlCl3水溶液作电解液,则阴极产物为 。
酸石粉主要成分为CaCO3。在下图各物质的相互转化中,K、I、J是日常生活中的调味剂,I、J、M、G为有机物,Mr(J)=60,Mr(M)=88,反应①②③均是工业生产中的重要反应。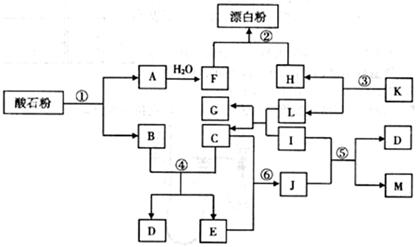
请回答下列问题:
(1)K的化学式:,J的分子式:。
(2)反应①中,含10g CaCO3的酸石粉,在 ℃、
℃、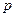 kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为。
kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为。
(3)反应④的化学平衡常数的表达式:K=,已知 则该反应是反应(填“吸热”或“放热”)。
则该反应是反应(填“吸热”或“放热”)。
(4)反应⑤的化学方程式为。
(5)反应⑥生成J,符合绿色化学原则的原因是。
已知有机物A分子中含有苯环且只有一个侧链,C中除苯环外还有一个四元环。有机物A的相对分子质量M不超过200,其中氧元素的质量分数为26.7%,完全燃烧只生成水和二氧化碳。与之有关的有机物转化关系如下:(注意:部分反应产物省略)
(1)①~⑤中所涉及的反应类型为;
(2)有机物A中含氧官能团的名称为________________,A的结构简式为____________。
(3)有机物C的结构简式为____________________________
(4)有机物A~F中互为同分异构体的有____________,______________(填写字母A、B、……)
(5)16.2g有机物B、C、D组成的混合物完全燃烧,消耗O2的物质的量为mol(6)写出A+D→E的化学方程式_____________________________。
物质A~K都是由下表中离子形成的,且为中学化学常见物质,有如图所示的转化关系。部分产物中的水已省略。(如果需要阴、阳离子可以重复使用)
已知C、D、J都是白色沉淀,其中D、J不溶于稀硝酸。试按要求回答下列相关问题:
(1)A、D、J的化学式为:A、D、J;
(2)相同条件下,物质的量浓度相同的B溶液和E溶液pH较大的是(用化学式表示);
(3)写出反应③的离子方程式:
(4)用惰性电极电解I溶液阳极的电极反应方程式为:
下图每一方框中的字母代表一种反应物或生成物:产物J是含A金属元素的胶状白色沉淀,I为NaCl溶液,D是淡黄色固体单质。试填写下列空白:
(1)L的化学式为:。
(2)F的化学式为:。
(3)写出J受热分解反应的化学方程式:。
(4)E的溶液呈酸性的原因(用离子方程式表示) ________________________。
(5)H和G之间反应的化学方程式为:________________________________。
氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)
和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随
c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-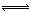 Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-
(1)反应开始时反应速率加快的原因是
(2)反应后期反应速率下降的原因是