2013年12月15日4时搭载长征系列火箭的“玉兔号”顺利驶抵月球表面,实现了五星红旗耀月球的创举。火箭升空需要高能燃料,通常用肼(N2H4)作燃料,N2O4做氧化剂。请回答下列问题:
(1)已知:N2(g) + 2O2(g) ="=" 2NO2(g) ΔH=+67.7kJ·mol-1
N2H4(g) + O2(g)="=" N2(g) + 2H2O(g) ΔH=-534.0kJ·mol-1
2NO2(g)  N2O4(g) ΔH=-52.7kJ·mol-1
N2O4(g) ΔH=-52.7kJ·mol-1
写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式: ;
(2)工业上用次氯酸钠与过量的氨气反应制备肼,该反应的化学方程式为: ;
(3)工业上可以用下列反应原理制备氨气:
2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=Q kJ·mol-1
4NH3(g)+3O2(g) ΔH=Q kJ·mol-1
①已知该反应的平衡常数K与温度的关系如图,则此反应的 Q 0 (填“>”“<”或“=”)。

②若起始加入氮气和水,15分钟后,反应达到平衡,此时NH3的浓度为0.3mol/L,则用氧气表示的反应速率为 。
③常温下,如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时, (选填编号).
| A.容器中气体的平均相对分子质量不随时间而变化 |
| B.v(N2)/v(O2)=2∶3 |
| C.容器中气体的密度不随时间而变化 |
| D.通入稀有气体能提高反应的速率 |
E.若向容器中继续加入N2,N2的转化率将增大
(4)最近华南理工大提出利用电解法制H2O2并以此处理废氨水,装置如图。

①为不影响H2O2的产量,需要向废氨水加入适量硝酸调节溶液的pH约为5,则所得废氨水溶液中
c(NH4+) c(NO3-)(填“>”“<”或“=”);
②Ir—Ru惰性电极有吸附O2作用,该电极的电极反应为 ;
③理论上电路中每转移3mol电子,最多可以处理NH3·H2O的物质的量为 。
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在郊
区(填标号);
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
(2)CuFeS2 是黄铁矿的另一成分,煅烧时CuFeS2转化为CuO、Fe2O3和SO2,
该反应的化学方程式为 。
(3)为提高SO3吸收率,实际生产中通常用吸收SO3。
(4)已知反应2SO2+O2 SO3△H <0,现将0.050mol SO2和0.030mol O2
SO3△H <0,现将0.050mol SO2和0.030mol O2
充入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得反应后容器压
强缩小到原来压强的75%,则该条件下SO2的转化率为________;该条件下的
平衡常数为__________。
(5)由硫酸厂沸腾炉排出的矿渣中含有Fe2O3、CuO、CuSO4(由CuO与SO3在
沸腾炉中化合而成),其中硫酸铜的质量分数随沸腾炉温度不同而变化(见下表)
| 沸腾炉温度/℃ |
600 |
620 |
640 |
660 |
| 炉渣中CuSO4的质量分数/% |
9.3 |
9.2 |
9.0 |
8.4 |
已知CuSO4在低于660℃时不会分解,请简要分析上表中CuSO4的质量分数随
温度升高而降低的原因。
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方
法可用(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产
水泥的辅料,写出这两步反应的化学方程式。
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是;
(3)已知SnO2是离子晶体,写出其主要物理性质;(写出2条即可)
(4)已知:
| CH4 |
SiH4 |
NH3 |
PH3 |
|
| 沸点(K) |
101.7 |
161.2 |
239.7 |
185.4 |
| 分解温度(K) |
873 |
773 |
1073 |
713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。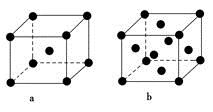
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 |
NaCl |
KCl |
CaO |
| 晶格能/kJ·mol-1 |
786 |
715 |
3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________。
(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是________。
(5)温室效应,科学家设计反应:CO2+4H2—→CH4+2H2O以减小空气中CO2。若有1 mol CH4生成,则有________mol σ键和________mol π键断裂。
在自来水消毒和工业上砂糖、油脂的漂白与杀菌过程中,亚氯酸钠(NaClO2)发挥着重要的作用。下图是生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出
NaClO2·3H2O;
②常温下,Ksp(FeS)=6.3×10-18;Ksp(CuS)=6.3×10-28;Ksp(PbS)=2.4 ×10-28
(1)反应I中发生反应的离子方程式为。
(2)从滤液中得到NaClO2·3H2O晶体的所需操作依次是(填写序号)。
a.蒸馏 b.蒸发浓缩 c.过滤 d.冷却结晶 e.灼烧
(3)印染工业常用亚氯酸钠(NaClO2)漂白织物,漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数:
| 弱酸 |
HClO2 |
HF |
H2CO3 |
H2S |
| Ka/mol·L-1 |
1×10-2 |
6.3×10-4 |
K1=4.30×10-7 K2=5.60×10-11 |
K1=9.1×10-8 K2=l.1×10-12 |
①常温下,物质的量浓度相等的NaClO2、NaF、NaHCO3、Na2S四种溶液的pH由大到小的顺序为 (用化学式表示);体积相等,物质的量浓度相同的NaF、NaClO2两溶液中所含阴阳离子总数的大小关系为:(填“前者大”“相等”或“后者大”)。
②Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+离子,滴加Na2S溶液后首先析出的沉淀是;常温下,当最后一种离子沉淀完全时(该离子浓度为10-5mol·L-1)此时体系中的S2-的浓度为。
(4)Ⅲ装置中生成气体a的电极反应式,若生成气体a的体积为1.12L(标准状况),则转移电子的物质的量为。
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入(填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式。
(2)如下图所示,过滤操作中的一处错误是。
(3)判断流程中沉淀是否洗净所用的试剂是,高温焙烧时,用于盛放固体的仪器名称是。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是,F中试剂的作用是。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为;