尿素[CO(NH2)2]是首个由无机物人工合成的有机物。工业上合成尿素的反应如下:
2NH3(g)+CO2(g)  CO(NH2)2(l) + H2O (l) ΔH<0。回答下列问题:
CO(NH2)2(l) + H2O (l) ΔH<0。回答下列问题:
已知工业上合成尿素分两步进行,相关反应如下:
反应Ⅰ:2NH3(g)+CO2(g)  NH2COONH4(s) ΔH1<0
NH2COONH4(s) ΔH1<0
反应Ⅱ:NH2COONH4(s)  CO(NH2)2(l)+ H2O (l) ΔH2>0
CO(NH2)2(l)+ H2O (l) ΔH2>0
(1)下列示意图中[a表示2NH3(g)+CO2(g),b表示NH3COONH4(s),c表示CO(NH2)2(l)+H2O(l)],能正确表示尿素合成过程中能量变化曲线是(填序号) 。

(2)某实验小组模拟工业上合成尿素的条件,在恒定温度下,将氨气和二氧化碳按2:1的物质的量之比充入一体积为10L的密闭容器中(假设容器体积不变,生成物的体积忽略不计),经20min达到平衡,各物质浓度的变化曲线如下图所示。

从图中得知∆c(CO2)=0.2mol/L,则v(CO2)= ∆c(CO2)/t= 0.01mol·L-1·min-1。
①在上述条件下,从反应开始至20min时,二氧化碳的平均反应速率为 。
②为提高尿素的产率,下列可以采取的措施有 。
| A.缩小反应容器的容积 |
| B.升高温度 |
| C.平衡体系中及时分离出CO(NH2)2 |
| D.使用合适的催化剂 |
③该反应的平衡常数表达式K= ;若升高体系的温度,容器中NH3的体积分数将 (填“增加”、“减小”或“不变”)。
④若保持平衡的温度和体积不变,25min时再向容器中充入2mol氨气和1mol二氧化碳,在40min时重新达到平衡,请在上图中画出25~50min内氨气的浓度变化曲线。
二甲醚与水蒸气重整制氢气作为燃料电池的氢源,比其他制氢技术更有优势。主要反应为:
① CH3OCH3(g) + H2O(g) 2CH3OH(g) ΔH=+37 kJ·mol-1
2CH3OH(g) ΔH=+37 kJ·mol-1
② CH3OH(g) + H2O(g)  3H2(g) + CO2(g) ΔH=+49 kJ·mol-1
3H2(g) + CO2(g) ΔH=+49 kJ·mol-1
③ CO2(g) + H2(g) CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
CO(g) + H2O(g) ΔH=+41.3 kJ·mol-1
其中反应③是主要的副反应,产生的CO能毒害燃料电池Pt电极。请回答下列问题:
(1)二甲醚可以通过天然气和CO2合成制得,该反应的化学方程式为
。
(2)CH3OCH3(g)与水蒸气重整制氢气的热化学方程式为
。
(3)下列采取的措施和解释正确的是。(填字母序号)
A.反应过程在低温进行,可减少CO的产生
B.增加进水量,有利于二甲醚的转化,并减少CO的产生
C.选择在低温具有较高活性的催化剂,有助于提高反应②CH3OH的转化率
D.体系压强升高,对制取氢气不利,且对减少CO的产生几乎无影响
(4)在温 度相同的3个密闭容器中,按不同方式
度相同的3个密闭容器中,按不同方式 投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
投入反应物,保持恒温、恒压,发生反应①,测得反应达到平衡时的有关数据如下。
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1mol CH3OCH3、1mol H2O |
2mol CH3OH |
1mol CH3OH |
| CH3OH的浓度(mol/L) |
c1 |
c2 |
c3 |
| 反应的能量变化 |
吸收a kJ |
放出b kJ |
放出c kJ |
| 平衡时体积(L) |
V1 |
V2 |
V3 |
| 反应物转化率 |
α 1 |
α 2 |
α 3 |
下列说法正确的是。(填字母序号)
A. a+2c="37" B. α1 + α2="1"  C. V1 > V3D. c1=
C. V1 > V3D. c1= 2c3
2c3
(5)以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极也可直接构成燃料电池。该电池中负极上的电极反应式是 。
。
(15分)某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+、Mg2+)作系列探究,装置如下图所示:
(1)电解时, 甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因
甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因
______________________________________________________________。
(2 )一段时间后,你认为C中溶液可能出现的现
)一段时间后,你认为C中溶液可能出现的现 象是__________________,请用离子方程式表示原因___________________________________________________。
象是__________________,请用离子方程式表示原因___________________________________________________。
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加人到稀盐酸中却没有任何现象。请用化学方程式和简要的文字解释原因:
____________________________________________________________________.
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去主要原因提出了如下假设,请你完成 假设二。
假设二。
假设一:B中逸出气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:__________________________________________。
(5)请你设计实验验证上述假设一,写出实验步骤及结论____________________________________________________________________。
在一个固定体积的密闭容器中,向容器中充入2 mol A 和1 mol B,发生如下反应:2A(g) + B(g)  2C(g) + D(g),达到平衡时C的浓度为0.4 mol·L-。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是1.2mol/L。
2C(g) + D(g),达到平衡时C的浓度为0.4 mol·L-。维持相同的温度和相同的容积,按下列四种配比作为起始物质,达到新平衡时C的浓度仍是1.2mol/L。
⑴若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应。
⑵若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度为1.2 mol/L的是_____ (用序号填空)。
| A.4 mol A+2 mol B | B.3mol C+1 mol D+1 mol B |
| C.3 mol C+ 2mol D | D.1.6mol A+0.8 mol B+0.6 mol C |
⑶某温度下,向容器中加入3mol C和0.8mol D,反应达到平衡时C的浓度仍为1.2mol/L,则容器的容积V应大于________L,小于________L。
乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙块。
⑴CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为;1mol O22+中含有的 键数目为。
键数目为。
⑵将乙炔通入[Cu(NH3)2]Cl溶液生成CaC2红棕色沉淀。Cu+基态核外电子排布式为。
⑶乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
N)。丙烯腈分子中碳原子轨道杂化类型是;分子中处于同一直线上的原子数目最多为。
⑷CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为。
X、Y、Z、W是元素周期表前四周中期中的四种常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z |
Z和Y同周期,Z的电负性大于Y |
| W |
W的一种核素的质量数为63,中子数为3 4 4 |
⑴Y和Z的最高价氧化物对应的水化物的酸性较强的是(写化学式)。
⑵XY2是一种常用的溶剂,XY2的分子中存在个 键。在H-Y、H-Z两种共价键中,键的极性较强的是,键长较长的是。
键。在H-Y、H-Z两种共价键中,键的极性较强的是,键长较长的是。
⑶W的基态原子核外电子排布式是。W2Y在空中在空气中煅烧生成W2O的化学方程式是。
⑷处理含XO、YO2烟道气 污染的一种方法,是将其在催化剂作用下转化为单质Y。
污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+ 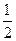 O2(g)====XO2(g) ΔH=-283kJ·mol-1
O2(g)====XO2(g) ΔH=-283kJ·mol-1
Y(s)+ O2(g)====YO2(g)ΔH=-296kJ· m
m ol-1
ol-1
此反应的热化学方程式是。