氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题: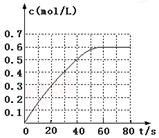
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,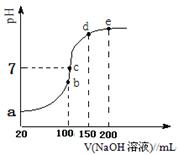
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
(1)向NaHSO4溶液中逐渐加入Ba(OH)2溶液至中性,写出反应的离子方程式:______________________________________________。
(2)在以上中性溶液中,继续加入Ba(OH)2溶液至沉淀完全,此步的离子方程式为: ____________________________________________。
按要求书写下列离子方程式或化学方程式:
①写出Ba(NO3)2溶液中加稀H2SO4的离子方程式:。
②写出将铁屑加入CuSO4溶液中的离子方程式:。
③将Cu2++2OH-=Cu(OH)2↓改写成化学反应方程式:。
④将CO32-+2H+=CO2↑+H2O改写成一个化学反应方程式:。
写出与下列每一个离子方程式对应的一个化学反应方程式:
(1)CO32-+2H+=H2O+CO2↑:。
(2)H++OH-=H2O:。
(3)Mg+2H+=Mg2++H2↑:。
(4)BaCO3+2H+=Ba2++H2O+CO2↑:。
有下列离子:K+、Mg2+、Ba2+、Na+、SO2-4、OH-、NO-3、Cl-等。按其在溶液中可大量共存的原则,将上述离子等分成两组(要求每组不少于两种阳离子和两种阴离子),则两组分别是______________________________,__________________________。
往平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O ]与氯化铵[NH4Cl]晶体,塞紧瓶塞。在木板上滴少量水,如下图所示。一会儿,就发现瓶内固态物质变成液体,瓶塞变冷,小木板上因少量水冻结而把烧瓶粘住,这时打开瓶塞,放出的气体有氨气的气味。这是自发的发生了吸热反应:。这个现象说明下列结论正确的是
| A.自发反应一定是吸热反应 | B.自发反应一定是放热反应 |
| C.有的吸热反应也能自发进行 | D.吸热反应不能自发进行 |
