【改编】下列叙述正确的是
| A.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12 |
| B.常温下,向AgCl的饱和溶液中加入NaCl固体,有固体析出,且AgCl的Ksp变小 |
| C.c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4) > c[(NH4)2SO4]> c(NH4Cl) |
| D.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
下列关于元素周期表和元素周期律的说法,正确的是
| A.目前发现的所有元素占据了周期表里全部位置,不可能再有新的元素被发现 |
| B.元素的性质随着相对原子质量的增加而呈周期性的变化 |
| C.同一主族的元素从上到下,金属性呈周期性变化 |
| D.俄国化学家门捷列夫为元素周期表的建立做出了巨大贡献 |
工业上由二氧化锰制备高锰酸钾可分二步进行,第一步:二氧化锰与氢氧化钾共熔并通入氧气2MnO2+4KOH+O2 2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+H2O
2K2MnO4+2H2O;第二步:电解锰酸钾溶液:2K2MnO4+H2O  2KMnO4+H2↑+2KOH下列说法叙述正确的是
2KMnO4+H2↑+2KOH下列说法叙述正确的是
| A.氧化性:KMnO4>K2MnO4>O2 |
| B.第二步电解时,KMnO4在阳极区生成 |
| C.根据上述过程,每生成1mol KMnO4共转移6mol电子 |
| D.第二步电解时阴极周围pH减小 |
相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:
2 SO2(g)+O2 (g) 2SO3(g)△H=-196.4 kJ/mol。
2SO3(g)△H=-196.4 kJ/mol。
实验测得起始、平衡时的有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
平衡时反应中的能量变化 |
||
| SO2 |
O2 |
SO3 |
||
| ① |
2 |
1 |
0 |
放出热量a kJ |
| ② |
1 |
0.5 |
1 |
放出热量b kJ |
| ③ |
4 |
2 |
0 |
放出热量c kJ |
下列叙述正确的是
A.放出热量关系:a = b B.三个容器内反应的平衡常数:③>②>①
C.平衡时SO3气体的体积分数:③>① D.SO2的转化率:②>①>③
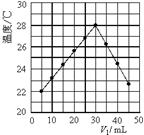
将V1 mL 1.0 mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是
| A.做该实验时环境温度为22 ℃ |
| B.该实验表明化学能可以转化为电能 |
| C.NaOH溶液的浓度约是1.5mol/L |
| D.该实验表明有水生成的反应都是放热反应 |
对苯二酚是摄影业中常用显影剂,它在水中电离出的阴离子对已曝光的AgBr有显影作用,有关变化可表示为:
则在以对苯二酚为主要成分的显影液中,能使显影速度明显加快的添加剂是
| A.KBr | B.Na2CO3 | C.CH3COOH | D.H2O |