【改编】铜制器物在潮湿环境中表面会产生绿色的锈迹,俗称铜绿。某化学学习小组对铜绿成分产生了浓厚兴趣。
【提出问题】铜绿中除铜元素外还有其它什么元素?
【查阅资料】①无水硫酸铜遇水变蓝色;②碳与一般的酸不反应;
【实验探究】该小组同学找到了一些铜绿粉末并进行了如下实验:

【观察分析】A装置中绿色粉末变为黑色;B装置中无水硫酸铜变为蓝色;
C装置中澄清石灰水变浑浊,该反应的化学方程式为 。
【实验结论】铜绿中除铜元素外还有 和碳等元素。
【交流讨论】根据铜绿的组成,小组同学对A装置中产生的黑色粉末的成分有如下两种不同的猜想:
(1)全部为CuO
(2)全部为C
(3)CuO和C的混合物
【深入探究】
| 实验步骤 |
实验现象 |
实验结论 |
| ①取少量黑色粉末于试管中,滴加足量的稀硫酸 |
①固体全部溶解,溶液颜色变蓝 |
猜想(1)正确 |
| ②取少量黑色粉末于试管中,滴加足量的稀硫酸 |
② |
猜想(2)正确 |
| ③取少量黑色粉末于试管中,滴加足量的稀硫酸 |
③(2分) |
猜想(3)正确 |
【实验结论】化学学习小组同学通过实验证明猜想(1)正确。
【反思应用】根据铜绿中所含元素,可知铜生锈不仅与空气中的氧气、水有关,还可能与空气中的 等有关;要保护博物馆里的青铜器,减缓生锈,我们可以减少青铜器与 接触。
小王同学在厨房中发现一袋白色粉末状的食用物,包装袋上表示的化学成分字迹不清,于是他带到实验室探究其成分。(填空每空1分,计算3分,计9分)
【猜想与假设】猜想1.可能是淀粉(不溶)
猜想2.可能是纯碱
猜想3.可能是食盐
猜想4.可能是 (俗称小苏打)
【查阅资料】小苏打溶液显碱性,与氯化钡溶液不反应,淀粉不溶解于水中
【实验探究】
| 实验操作 |
实验现象 |
实验结论 |
| (1)取样,溶于适量的水 |
形成无色溶液 |
猜想 不成立 |
| (2)取少量品尝 |
有涩味 |
不是 |
| (3)向(1)的溶液中滴加酚酞试液 |
溶液变红 |
是纯碱 |
小华认为,实验(3)结论不准确,原因是。小华进行了如下实验:取28g所配溶液与50.2g氯化钡溶液混合,两种物质恰好完全反应。立即出现,由此他知道了该白色粉末是何物。过滤,所得滤液质量为58.5g,试计算:
(4)反应后生成的沉淀质量为克。
(5)所得滤液中溶质的质量分数为多少?
现实验室有一瓶久置的NaOH溶液,为检验其是否变质,溶液中的溶质是什么,九(5)班同学设计实验并进行验证。
【提出问题】待测液中的溶质是什么?
(1)请你用化学方程式写出NaOH溶液变质的原因:
【提出猜想】
(2)猜想一:NaOH,猜想二:Na2CO3,猜想三:
【设计方案】
(3)实验方案(一):取少量待测溶液于试管中,向其中滴加无色酚酞溶液,若溶液变红,则说明该待测溶液没有变质,猜想一正确。
请你判断该方案是否合理,理由是
实验方案(二):取少量待测溶液于试管中,向其中滴加几滴稀盐酸,若溶液中没有出现气泡,则说明该待测溶液没有变质了,猜想一正确。小陈同学认为该结论不合理,请你想一想他的理由。
实验方案(三):取少量待测溶液于试管中,先向其中加入足量的澄清石灰水,再加入无色酚酞,若观察到先有白色沉淀产生,后溶液变红的现象,则说明猜想三正确。请你写出发生的方程式。小刘同学提出异议,原因是 。
实验方案(四):取少量待测溶液于试管中,先向其中加入足量的BaCl2溶液,再加入无色酚酞,
若观察到现象,则说明猜想三正确。
【实验结论】该溶液为部分变质的NaOH溶液。
【反思交流】CO2与NaOH溶液反应没有明显现象,除了选用试剂验证产物碳酸钠的存在能证明两者可以反应外,是否有其他办法证明两者反应呢?
(4)下列四种实验设计,实验中其现象不足以说明CO2与NaOH溶液发生了反应的是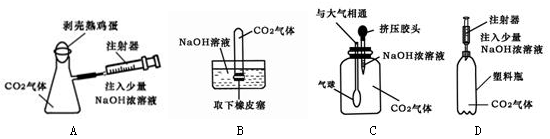
同学们在学完酸的化学性质后,做了如下实验: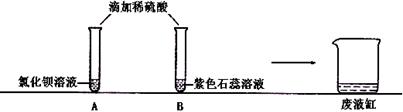
同学们观察到A试管中有(1)现象。
实验结束,同学们依次将A、B试管中的废液缓慢倒入同一洁净的废液缸中,观察到废液显红色。
为了科学处理实验后产生的废液,同学们决定对废液缸中废液的溶质成分(不考虑石蕊)进行探究。
【查阅资料】钡离子有毒。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】甲同学猜想:废液中只含有HCl [来一种溶质。
乙同学猜想:废液中含有HCl、BaCl2两种溶质。
丙同学的猜想:(2)。
【表达与交流】甲同学猜想的理由是(3)__________________________________。
【活动与探究】同学们为了验证以上猜想,继续进行实验:
甲同学:取少量废液于试管中,滴加少量的氯化钡溶液,未观察到明显现象。
乙同学:取少量废液于试管中,滴加少量的碳酸钠溶液,看到产生气泡。
丙同学:取少量废液于试管中,滴加少量的硫酸钠溶液,看到产生白色沉淀。
【结论与应用】通过分析甲、乙、丙三位同学们的实验及现象,最终确认(4)(填甲、乙、丙)猜想正确,你认为处理该废液的方法是(5)。
过氧化钠(Na2O2)可用作呼吸面具的供氧剂.实验室有一瓶放置较长时间的过氧化钠样品,某研究小组对其成分和性质进行了如下探究.
【查阅资料】过氧化钠能与空气中水和二氧化碳反应生成氧气:
2Na2O2 +2H2O=4NaOH+O2↑, 2Na2O2+2CO2==2Na2CO3+O2.
【提出问题】过氧化钠是否变质?
【猜想与假设】假设1:过氧化钠未变质;
假设2:过氧化钠部分变质;
假设3:过氧化钠全部变质.
【实验探究】
| 序号 |
实验步骤 |
实验现象 |
实验结论 |
| ① |
取部分固体于试管中,加人足量的水,在试管口播人带火星的木条; |
固体完全溶解,木条复然 |
假设____ 不成立 |
| ② |
取少量①中溶液于试管中,滴加足量的__ ____,振荡. |
有气泡生成 |
假设2成立 |
【提出新问题】部分变质的过氧化钠中是否含有氢氧化钠?
【实验探究】实验③:取少量①中溶液于试管中,加人足量的氯化钙溶液,有白色沉淀生成,静置,向上层清液中滴加2滴无色酚酞试液,溶液变红.
【定性分析】(1)由实验③可以确定①中溶液含有的溶质是___________(填化学式);实验③中所发生的化学方程式为:_____________________
(2)小明认为,由上述实验无法确定原固体样品中是否含有氢氧化钠,理由是_______。
【反思与提高】过氧化钠长期暴露在空气中,最终会变质为______(填化学式)
如图是模拟海水制盐的流程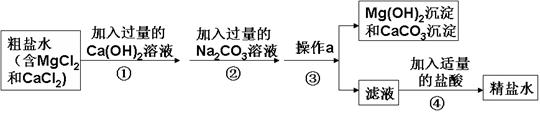
(1)为了证明第①步所加的Ca(OH)2溶液已过量,某同学取少量①反应后的上层清液,向其中继续加入Ca(OH)2溶液,若(填实验现象),则证明Ca(OH)2溶液已过量.
(2)实验结束后,兴趣小组对滤液进行探究
【提出问题】滤液中除了含有水和氯化钠外,还含有哪些溶质?
【提出猜想】根据实验①②③的操作后,作出如下猜想
猜想一:由于在②中加入了过量的碳酸钠溶液,所以滤液中除了含有水和氯化钠外,还仅含过量的.
猜想二:由于在①加入了过量的氢氧化钙,发生反应生成了氢氧化镁和氯化钙,所以滤液中除了含有水和氯化钠外,只含有反应生成的氯化钙.
猜想三:由于②所加的过量碳酸钠在①之后,所加的碳酸钠把①中反应生成的氯化钙和过量的氢氧化钙全部除去,所以滤液中除了含有水和氯化钠外,还含有.
【验证猜想】
| 步骤 |
实验操作 |
实验现象 |
推断 |
| 1 |
取少量滤液于试管中,加入过量的氯化钙溶液,振荡,静置 |
滤液中还含有 |
|
| 2 |
取步骤1反应后的混合液过滤后,取滤液少量于试管中加入 |
滤液中还含有氢氧化钠 |
【实验结论】经过兴趣小组的实验分析,推出猜想三是正确的.
【反思与拓展】为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质,请写出其中一个反应的化学方程式:.如果要将精盐水继续提纯成NaCl晶体,应进行操作.
【定量计算】若用上述NaCl晶体配制溶液,取一定质量的该溶液加入足量的AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液质量.请计算原NaCl溶液中溶质的质量分数。