下图物质为初中化学常见物质,请根据叙述回答问题:(“→”表示转化关系,“—”表示反应关系)。
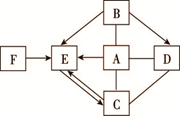
(1)甲为银白色金属,能与溶液A反应得到浅绿色溶液,则甲的化学式为 。
(2)乙为厨房内常用的调味品,可由A、B两种溶液发生中和反应得到,则A与B反应的化学方程式为 。
(3)固体C常用于改良酸性土壤,且C与D反应可得到B,则C与D反应的化学方程式为 。
(4)E、F的物质类别相同,且E与F能反应放热,F也能与A溶液发生反应,则F与A反应的化学方程式为 。
(5)若将盛有饱和C溶液的小烧杯放入一只大烧杯中,并在大烧杯中加入下列物质,观察到小烧杯中饱和C溶液变浑浊,则加入的物质组合可能是 (填序号)。
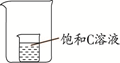
①氢氧化钠固体和水
②镁和稀盐酸
③硝酸铵固体和水
④氯化钠固体和水
⑤碳酸氢钠和稀盐酸
结合如图回答问题。

(1)仪器名称:a ,b 。
(2)用氯酸钾和二氧化锰制取氧气,可选用装置 (选填序号)和D组合,反应的化学方程式为 ,二氧化锰的作用是 。
(3)用如图装置制取 并验证相关性质。
并验证相关性质。

①装置F中发生反应的化学方程式为 。
②装置F相对于装置B的优点是 。
③ 可用装置C收集,原因是 。
可用装置C收集,原因是 。
④关闭 ,打开
,打开 ,装置G中溶液变红;关闭
,装置G中溶液变红;关闭 ,打开
,打开 ,装置J中溶液变红。将变红的两溶液加热相同时间,装置J中溶液变成紫色,而装置G中溶液仍显红色。
,装置J中溶液变红。将变红的两溶液加热相同时间,装置J中溶液变成紫色,而装置G中溶液仍显红色。
Ⅰ.装置G中溶液仍显红色的原因是 。
Ⅱ.装置Ⅰ的作用是 。
请根据下列实验装置图回答问题。

(1)实验室制取氧气有多种方法:
①用装置A制取氧气,反应的化学方程式为 。用装置E收集氧气,检验是否集满的方法是 (写出操作、现象和结论)。
②用过氧化氢溶液和 混合制取氧气,反应后通过 、洗涤、干燥等操作回收 。
(2)实验室制取二氧化碳的化学方程式为 ,选择的装置组合是 (填字母),其中 (填仪器名称)用来添加稀盐酸。
(3)实验室常借助传感器研究气体的性质与变化。蜡烛在充满空气的密闭集气瓶内燃烧,稍后熄灭,同时用氧气传感器采集瓶内氧气浓度变化的数据,如图所示。分析该实验可知:
①可燃物燃烧的条件之一是 。
②当氧气浓度变为 %时蜡烛不再燃烧。
③蜡烛熄灭后集气瓶中含量最多的气体是 。

如图为实验室常用仪器和装置的示意图,根据题意回答问题。

(1)写出标号①的仪器名称 。
(2)实验室用双氧水和二氧化锰制取氧气的化学方程式为 ,可选用的发生装置为 (填序号)。
(3)收集装置中, (填序号)装置收集到的氧气最纯净。
(4)若用F装置干燥氧气,气体应从导管 (填“a”或“b”)端通入。
在实验室里,常采用下列实验装置制取和收集气体。请回答下列问题:

(1)写出图中仪器①的名称 。
(2)在实验室里选择A装置用加热 的方法制取氧气时,应在试管口放一团棉花,其作用是 。
(3)在实验室里常用锌粒和稀硫酸反应制取氢气,其化学方程式为 ;制取氢气时,若要随时控制反应的发生和停止,最好选择装置 。
(4)某同学要收集二氧化碳气体,可选用的收集装置除了E以外,还可以是: 。
实验中,可以根据反应物的状态和反应类型选择相同的装置制取不同气体,根据下列图示回答问题:

(1)图中①的名称是 。
(2)实验室用过氧化氢和二氧化锰制取氧气,可以选择 (用A~F填空)作为发生装置。该装置还可以用于制取二氧化碳气体,写出实验室用稀盐酸和大理石制取二氧化碳的化学方程式: 。制取得到的 气体中往往含有 杂质可以选用装置F除去,除杂时气体应从 (填“a”或“b)端通入。
(3)以上装置中可同时用于实验室收集 和 的是 (A~F填空)。