A~H是初中化学常见的物质,其中E为黑色固体,H为蓝色沉淀,这些物质的相互转化关系如图所示,其中部分生成物和反应条件已省略.
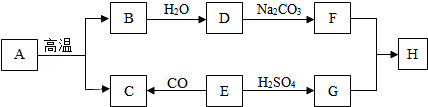
(1)写出下列物质的化学式:A ,G ,H .
(2)化学反应常伴有能量变化,物质B与水反应时会 (“吸收”或“放出”)热量.
(3)写出D→F的化学方程式: .
(4)写出E→C的化学方程式: .
(7分)(1)请用合适的化学用语(数字以及化学符号)填空:
①金元素;
②构成氯化钠的微粒是;
③2个硝酸根离子;
④由8个硫原子构成的分子;
(2)化学是一门以实验为基础的科学。图1~2是教科书上有关实验的装置图:
①图1是利用足量红磷燃烧来测定空气中氧气的含量。通过此实验可以得出的结论是:。
②图2是电解水实验。用化学符号表示此实验发生化学反应的式子是。通电一段时间后切断电源,用燃着的木条分别在两个玻璃管尖嘴口检验反应产生的气体,其中负极端的玻璃管内产生气体的检验现象是 。
京沪高速上,一辆槽罐车上满载的液态氯气快速泄漏,由于与事故发生地相距300m的地方是村庄,因此,此次液氯泄漏导致数十人死亡。信息链接:①氯气为黄绿色气体;②有强烈刺激性气味;③在常温下,氯气可溶于水,在高压下可以液化,并装入槽罐车中进行运输;④氯气密度为3.21g/L(空气为1.293g/L);⑤氯气可与氢气等非金属单质反应;⑥也可与钠、镁等金属单质反应;⑦还能与氢氧化钙反应生成次氯酸钙Ca(ClO)2、氯化钙和水。
(1)①-⑦中,属于氯气物理性质的是(填序号);
(2)请说明储存氯罐内温度升高是否会引发爆炸,为什么?
(3)写出氯气和氢氧化钙反应的符号表达式:。
2013年10月浙江余姚发生了建国以来最大的洪涝灾害。
(1)洪涝灾害期间,水源溶液收到细菌、病毒、寄生虫的污染。饮用水的消毒方法很多,简单实用的是;
(2)灾民用下列几个步骤将河水转化为饮用水:①化学沉降(用明矾);②消毒杀菌(用漂白粉);③自然沉降;④加热煮沸。以上处理过程顺序合理的是
| A.③②①④ | B.③①④② | C.③①②④ | D.①③④② |
I、向水样中加入明矾搅拌溶解,静置一段时间后,进行(填操作名称),除去固体小颗粒,该实验用到的一仪器和用品有(填序号)
①带铁圈的铁架台②试管③漏斗④玻璃棒⑤集气瓶⑥烧杯⑦滤纸
II、再向滤液中加入活性炭,利用其除去水样中的颜色和异味,该过程属于变化(填“物理”或者“化学”)
小李同学和王老师为探究人体呼出的气体和空气成分的差异,进行的实验如下,小李同学用玻璃管向盛满水的集气瓶中吹气,用排水法收集一瓶呼出的气体,将另一集气瓶充满新鲜的空气,将两根燃着的小木条,分别移到两只集气瓶口处移开玻璃片,慢慢伸入集气瓶中,观察实验现象。王老师将塑料袋内的空气排尽,然后向袋内吹气,收集一定体积的 呼出的气体,利用仪器侧定气体成分(见表).
表1:室内空气与正常呼吸方式呼出气体中部分气体的含量(体积分数)比较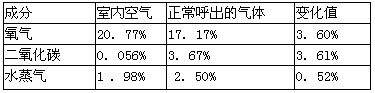
人呼出的气体中除含有氧气、二氧化碳、水蒸气外,还含有的主要物质________
小李同学用排水法收集呼出的气体中二氧化碳的量偏小,原因是______________
(3)小李同学进行实验时,发现伸人盛有人呼出气休的集气瓶中燃着的小木条先熄灭其原因可能是_________(写一点即可)
(4)①由表1可知,室内气体与正常呼出的气体相比较,______(填化学式)的含量变化较大,且变化量基本相等。
②人体内的氧气能和许多物质发生反应,写出有机物C6H10O5)和氧气反应,生成二氧化碳和水的化学反应方程式__________________________
我们已经学过实验室制取O2、CO2两种气体的反应原理、制取与收集方法,请你归纳出实验室制取这两种气体反应的共同点(填序号)
A.需要加热B.需要催化剂C.反应物只有一种D.生成的气体只有一种
(1)请你根据提供的实验仪器和药品参与实验室制气体制备的研究和实践,实验仪器如下图所示。(导管和橡皮塞等未画出)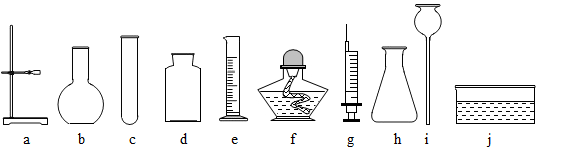
实验药品:6%双氧水、大理石、稀盐酸、高锰酸钾、二氧化锰
【比较研究】请填写下表
【实践探究】
(1)某同学选用a,c,d,f,j等组装制取和收集氧气装置,该同学反应所用原理为:(用符号表达式表示)用该收集氧气的装置应如何验满?
(2)四位同学根据提供的实验仪器分别设计了下列四套制取和收集二氧化
碳的装置。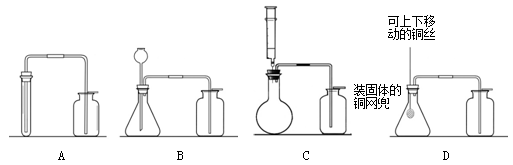
实验室制取二氧化碳的符号表达式为:他们对设计的装置相互进行了交流评价。其中可能收集不到二氧化碳气体的装置是;能够使反应随时停止和发生的装置是,用该方法收集二氧化碳应如何验满?
【反思小结】气体制取和收集装置的选择依据
发生装置------药品的状态和
收集装置------、和化学性质中的
【拓展运用】
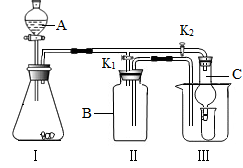
某同学还设计了如下制取并验证气体性质的装置(K1K2为玻璃导管上开关)
(1)当打开K1,关闭K2时,用I、II装置可直接进行的实验是
A.大理石与稀盐酸反应制取二氧化碳
B.金属锌与稀盐酸反应制取氢气(反应不需要加热)
C.氯酸钾和二氧化锰混合制取氧气
(2)小李同学认为在不改变I、II装置的仪器和位置的前提下,该装置可用于双氧水制取氧气,他的做法是: