以下是处于研究阶段的“人工固氮”的新方法.N2在催化剂表面与水发生反应:
2N2(g)+6H2O(l)⇌4NH3(g)+3O2(g) △H="+" 1530.4kJ/mol;完成下列填空:
(1)该反应平衡常数K的表达式 .
(2)上述反应达到平衡后,保持其他条件不变,升高温度,重新达到平衡,则 .
a.平衡常数K增大
b.H2O的浓度减小
c.容器内的压强增大
d.v逆(O2)减小
(3)研究小组分别在四个容积为2升的密闭容器中,充入N2 1mol、H2O 3mol,在催化剂条件下进行反应3小时.实验数据见下表:
| 序号 |
第一组 |
第二组 |
第三组 |
第四组 |
| t/℃ |
30 |
40 |
50 |
80 |
| NH3生成量/(10﹣6mol) |
4.8 |
5.9 |
6.0 |
2.0 |
第四组实验中以NH3表示反应的速率是 ,与前三组相比,NH3生成量最小的原因可能是 .
(4)氨水是实验室常用的弱碱.
①往CaCl2溶液中通入CO2至饱和,无明显现象.再通入一定量的NH3后产生白色沉淀,此时溶液中一定有的溶质是 .请用电离平衡理论解释上述实验现象 .
②向盐酸中滴加氨水至过量,该过程中离子浓度大小关系可能正确的是 .
a.c(C1﹣)=c(NH4+)>c(H+)=c(OH﹣)
b.c(C1﹣)>c(NH4+)=c(OH﹣)>c(H+)
c.c(NH4+)>c(OH﹣)>c(C1﹣)>c(H+)
d.c(OH﹣)>c(NH4+)>c(H+)>c(C1﹣)
火柴头上通常含有氯酸钾、二氧化锰、硫等物质。某研究性学习小组进行火柴头中有关物质的实验探究: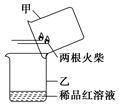
(1)某同学研究了教材中的实验装置后提出用如图所示方法进行实验更为简便。他的操作是:
A.当图中所示火柴头燃烧完时,立即移出火柴;
B.________________________________________________________________________
________________________________________________________________________。
(2)测定火柴头中KClO3的含量主要实验步骤如下:
A.刮取火柴头,小心研碎,称得其质量为2.45 g ;
B.用适量蒸馏水充分浸泡后过滤、洗涤残渣;
C.往装有滤液和洗涤液的烧杯中加入过量的NaNO2溶液、AgNO3溶液和稀硝酸,搅拌,充分反应后,过滤、洗涤沉淀;
D.干燥沉淀物,称得其质量为1.435 g。
①实验中发生的反应是KClO3+3NaNO2+AgNO3===AgCl↓+3NaNO3+KNO3,反应中AgNO3、NaNO2均需要过量的原因是
________________________________________________________________________;
②实验测得火柴头中KClO3的质量分数为__________;
③如果B步骤中未洗涤沉淀残渣,测得KClO3的质量分数将____________(填“偏大”、“偏小”或“无影响”,下同),如果C步骤中未洗涤AgCl沉淀,测得KClO3的质量分数将____________。
2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED晶片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主。砷化镓的晶胞结构如图。试回答: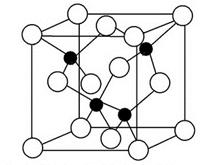
(1)镓的基态原子的电子排布式是_______。
(2)砷化镓晶胞中所包含的砷原子(白色球)个数为______,与同一个镓原子相连的砷原子构成的空间构型为______。
(3)下列说法正确的是_________(填字母)。
A.砷化镓晶胞结构与NaCl相同
B.第一电离能:As<Ga
C.电负性:As>Ga
D.GaP与GaAs互为等电子体
(4)N、P、As处于同一主族,其氢化物沸点由高到低的顺序是_________。
(5)砷化镓可由(CH3)3Ga和AsH3在700 ℃时制得。(CH3)3Ga中镓原子的杂化方式为________。
氮及其化合物在生活、生产和科技等方面有重要的应用。请回答下列问题:
(1) Li3N晶体中氮以N3-存在,基态N3-的电子排布式为________。
(2)氮元素可以形成卤化物、氮化物、叠氮化物及配合物等多种化合物。
①NF3、NBr3、NCl3的沸点由高到低的顺序是,其中NF3中N原子的杂化类型是,分子的空间构型是。
②叠氮酸(HN3)是一种弱酸,可电离出N3-,其电离方程式。另写出两种与N3-互为等电子体的分子、。
③氮元素的氢化物—NH3是一种易液化的气体,其易液化的原因是;
(3)配合物[Cu(NH3)4]Cl2中Cu2+的配位数是。
(4) (CH3)3NH+和AlCl4—可形成离子液体。离子液体由阴、阳离子组成,熔点低于100℃,其挥发性一般比有机溶剂________(填“大”或“小”),可用作________(填代号)。
a.助燃剂 b.“绿色”溶剂 c.复合材料d.绝热材料
根据下面的反应路线及所给信息填空。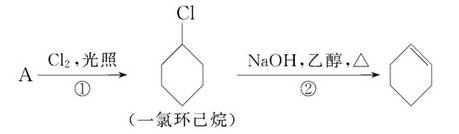
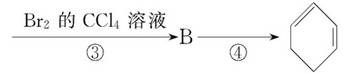
(1)A的结构简式是_______,名称是________。
(2)①的反应类型是________,③的反应类型是________。
(3)反应④的化学方程式是____________。
(1)在A~F中:
| A.11H和21H |
| B.甲烷和己烷 |
| C.金刚石和石墨 |
| D.正丁烷和异丁烷 |
E.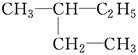 和
和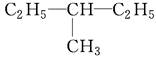
F.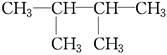 和
和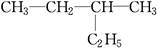
①属于同分异构体的是________,②属于同位素的是________,③属于同素异形体的是________,④属于同一种物质的是________。
(2)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式______,并写出其所有可能的结构简式__________________。