某小组的同学欲探究NH3经一系列反应得到HNO3和NH4NO3的过程,NH3的转化过程如下图所示。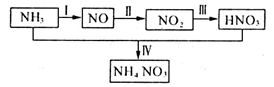
甲、乙两同学分别按下图所示装置进行实验。
用于A、B装置中的可选药品:浓氨水、30%H2O2溶液、蒸馏水、NaOH固体、MnO2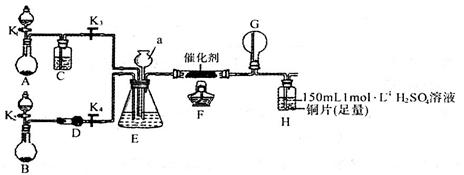
(1)仪器a的名称是____,装置A的圆底烧瓶中发生反应的化学方程式为___________________。装置E有多种作用,下列关于装置E的作用或其中所盛液体的说法中,不正确的是_________(填下列序号字母)。
a.使氨气和氧气充分混合 b.控制通入氨气和氧气的体积比
c.平衡装置内的压强 d.锥形瓶内液体是饱和食盐水
(2)甲同学先点燃酒精灯,再打开K1、K2、K3、K4,反应一段时间后,他认为成功模拟了过程Ⅱ的反应,原因是其观察到__________(填支持其观点的实验现象);甲同学进行的实验中产生的气体持续通入装置H一段时间后,H中的溶液变成蓝色,则其中铜片所参与反应的离子方程式为_____________,若制得的氨气仅按I→Ⅱ→III的顺序完全转化为硝酸,欲使H装置中所得溶液为纯净的CuSO4溶液(忽略Cu2+的水解),理论上所需氨气在标准状况下的体积为______L(假设硝酸与铜反应产生的还原产物全部排出反应装置);从所得CuSO4溶液中得到CuSO4·5H2O晶体的法是将溶液____、____、过滤、洗涤、干燥。
(3)乙同学为模拟过程IV的反应,在甲同学操作的基础上对该装置进行了下列各项中的一项操作,使G处圆底烧瓶中产生大量白烟,你认为这项操作是_____(填下列序号字母)。
a.关闭K3并熄灭酒精灯
b.关闭K4并熄灭酒精灯
c.关闭K3、K4并熄灭酒精灯
(4)丙同学认为该系列实验装置存在一处明显的设计缺陷,你认为该设计缺陷是______________。
草木灰中含有可溶性钾盐(主要成分是K2SO4、K2CO3、KCl)。某学生按下列操作提取草木灰中的钾盐:①取草木灰加水溶解;②过滤取滤液;③蒸发滤液;④冷却结晶。
(1)在操作①、②、③中均用到玻璃棒,该仪器的目的依次是、、。
(2)为检验草木灰中的阴离子,取少量晶体溶于水,并把溶液分成三等份:
①取一份溶液,加入适量HCl,观察到,证明含有碳酸根。
②取另一份溶液,为检验SO42-,应往溶液中加入。
③取剩余的一份溶液,加适量的硝酸银,观察到有沉淀产生,该生由此证明溶液中一定含Cl-。你认为该生所得的结论是否严密?。为什么?。
如图是制取无水氯化铜的实验装置图,将浓盐酸滴加到盛有二氧化锰粉末的圆底烧瓶中。请回答下列问题: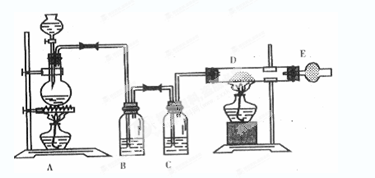
(1)盛放浓盐酸的仪器名称为____;
(2)烧瓶中发生反应的化学方程式;
(3)C瓶中的试剂是____;其作用是____;
(4)玻璃管D中发生反应的化学方程式;反应现象是___;
(5)干燥管E中盛有碱石灰(CaO+NaOH),其作用是____。
为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
(1)判断BaCl2已过量的方法是。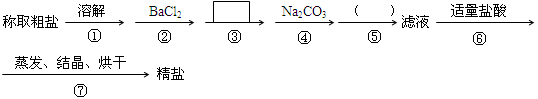
(2)第④步中,写出相应的离子方程式:; ____________________________.
(3)在 中填写所使用除杂试剂的化学式__________,在()中的操作名称是_______。
中填写所使用除杂试剂的化学式__________,在()中的操作名称是_______。
(4)从实验设计方案优化的角度分析步骤②和④可否颠倒____________(填“是”或“否”,如果“否”,请说明理由。)原因是:_______________________________________________;
步骤③和④可否颠倒____________。
(5)若先用盐酸再进行操作⑤,将对实验结果产生影响,其原因是:。
掌握仪器的名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。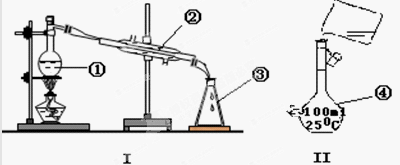
⑴写出下列仪器的名称:
①____________;②_____________;④__________;
⑵仪器①~④中,使用时必须检查是否漏水的有______。(填序号)
⑶若利用装置I分离四氯化碳和乙醇的混合物,还缺少的仪器是_________,将仪器补充完整后进行的实验操作的名称为_____________ 。现需配制250 mL 0.2 mol/L NaCl溶液,装置II是某同学转移溶液的示意图,图中的错误是______________、_________________ 。
用18.4mol/L的浓硫酸稀释成0.92mol/L的稀硫酸100ml,回答下列问题:
(1)
| 应取浓硫酸的体积/ml |
应选用容量瓶的规格/mL |
除容量瓶外还需要的其它仪器 |
(2)配制操作可分解成如下几步:
A.向容量瓶中注入少量蒸馏水,检查容量瓶是否漏水
B.用少量蒸馏水洗涤烧杯,将溶液注入容量瓶,并重复操作两次
C.将已冷却的硫酸注入容量瓶中
D.根据计算,用量筒量取一定体积的浓硫酸
E.将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F.盖上容量瓶塞子,振荡,摇匀,装瓶
G.用胶头滴管继续加蒸馏水,使溶液凹面恰好与刻度相切
H.继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
正确的操作顺序是:A____________________________F
(3)下列操作结果,使溶液物质的量浓度偏低的是
A.没有将洗涤液转移到容量瓶中
B.容量瓶洗净后未经干燥处理
C.转移过程中有少量的溶液溅出
D.摇匀后立即观察,发现溶液未达刻度线,没有再用滴管加几滴蒸馏水至刻度线