下列溶液中微粒的物质的量浓度关系正确的是
A.常温下电离常数为Ka的酸HA 溶液中 c (H+)=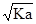 mol·L-1 mol·L-1 |
| B.0.2mol·L-1 CH3COOH溶液与0.1mol·L-1NaOH溶液等体积混合2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
| C.将饱和Na2SO4溶液加入到饱和石灰水中,有白色沉淀产生,说明Ksp[Ca(OH)2]大于Ksp(CaSO4) |
| D.常温下,向0.1mol/L NH4HSO4溶液中滴加NaOH溶液至中性c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+) |
归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)="2" B (g) △H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ.mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
已知Br2+ 2Fe2+ = 2Fe3++ 2 Br-,当向含1 molFeBr2溶液中逐渐通入Cl2,溶液中有一半的Br-氧化时,下列判断不正确的是
| A.反应前后溶液的颜色发生了改变 |
| B.反应后溶液中c(Cl-)= C(Br-) |
| C.参加反应的Cl2为1 mol |
| D.反应的离子方程式为:2Fe2++ 2Br- + 2Cl2= 2Fe3++ Br2 + 4Cl- |
香柠檬酚具有抗氧化功能。它的结构简式如右图,下列说法正确的是
| A.它的分子式为C13H9O4 |
| B.它与H2发生加成反应,1mol最多可消耗7mol H2 |
| C.它与Br2发生取代反应,1mol最多消耗3molBr2 |
| D.它与NaOH溶液反应,1mo1最多消耗3molNaOH |
如图所示是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
| A.R的单质能与W的氢化物反应,可证明非金属性:R>W |
| B.最高正价氧化物对应的水化物的酸性:R<W |
| C.X与Z组成的化合物是共价化合物,且又具有两性 |
| D.离子半径:Z>Y>X |
下列操作会导致实验结果偏高的是
| A.用天平称量20.5g某物质。砝码和药品的位置放反,所得药品的质量 |
| B.测定Na2CO3溶液的pH时先将pH试纸润湿了再测定,所测得的pH值 |
| C.配制一定物质的量浓度溶液时,定容时仰视读数,所得溶液的浓度 |
| D.酸式滴定管在盛装标准溶液前没有用标准溶液润洗,测得的待测液浓度 |