下表列出了A~M 13种元素在周期表中的位置:
| 族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
B |
C |
D |
E |
|
| 3 |
F |
G |
H |
|
|
I |
J |
K |
| 4 |
L |
M |
|
|
|
|
|
|
(1)这些元素中,金属性最强的元素是___________(填元素名称),非金属性最强的元素是________(填元素名称),最不活泼的元素是________(填元素符号),原子半径最小的元素是_______(填元素符号)。
(2)写出C元素的气态氢化物与I元素的最高价氧化物的水化物反应的化学方程式:______________。
(3)将C、D、E三种元素的氢化物按还原性增强的顺序排列为________。(用化学式表示)
(4)I2—、J-、L+、M2+等微粒中,半径最大的是_________(填离子符号)。
(5)A与D形成的化合物A2D2是______化合物(填共价或离子),其电子式为__________。
从能量的角度看,断开化学键要,形成化学键要。一个化学反应是释放能量还是吸收能量取决于。
写出下列物质的电子式:①KCl;②Cl2;③H2O。
短周期元素中,A元素原子最外层电子数是次外层电子数的2倍;B元素的最高正价是+6价;C元素原子M层电子数等于其L层电子数的一半;D元素原子最外层有1个电子,D的阳离子与氖原子的电子层结构相同,则
(1)A:B:C:D:(填元素符号)
(2)B元素与氢元素形成的化合物所含化学键为(填 “共价键”或“离子键”)
下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
① |
② |
③ |
|||||
| 3 |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
(1)元素⑥名称为在周期表中位于第周期,第族,元素⑧的原子结构示意图是。
(2)⑥、⑦氢化物的稳定性> (填化学式)。
(3)①、②、③三种元素按原子半径由小到大的顺序依次为(填元素符号)。
(4)在最高价氧化物的水化物中,酸性最强的化合物的分子式是;碱性最强的化合物的是_____________,该化合物属于(填 “共价”或“离子”)化合物。
(5)④元素与⑦元素形成的化合物的电子式是,高温下灼烧该化合物时,火焰呈色。
(6)元素⑤的单质与稀硫酸的反应是(填“放热”或“吸热”)反应。
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要,形成化学键要。
(2)在生产和生活中经常遇到化学能与电能的相互转化。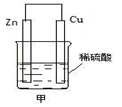
如图甲是将能转化为能的装置,负极电极反应式为,发生______反应(填“氧化”或“还原”,下同)。正极现象,发生______反应;发生反应时,电子由_____片流向_____片。当导线中有2 mol电子通过时,正极上析出g 氢气。