工业上可利用反应2NaClO3 + SO2 + H2SO4= 2ClO2 + 2NaHSO4来制取ClO2,下列关于该反应的说法正确的是
| A.SO2发生还原反应 | B.NaClO3失去电子 |
| C.H2SO4作氧化剂 | D.1mol氧化剂得到1mol电子 |
将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。已知反应:2NO2(红棕色) N2O4(无色) △H<0。下列说法正确的是
N2O4(无色) △H<0。下列说法正确的是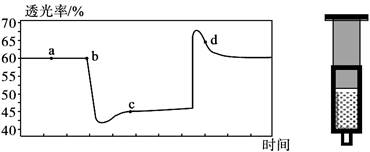
| A.b点的操作是拉伸注射器 |
| B.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| C.d点:υ(正)> υ(逆) |
| D.若注射器绝热(不与外界进行热交换),则压缩达新平衡后平衡常数K值减小 |
下列实验装置正确,且能达到实验目的的是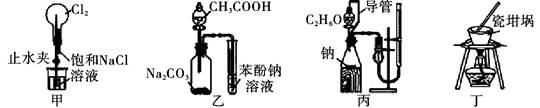
| A.用装置甲进行喷泉实验 |
| B.利用装置乙证明酸性:CH3COOH>H2CO3>苯酚 |
| C.利用装置丙测定乙醇结构式 |
| D.用装置丁加热熔融NaOH固体 |
下列有关SO2的叙述正确的是
| A.通入Ba(NO3)2溶液可生成白色沉淀 |
| B.使溴水溶液褪色,体现其漂白性 |
C.通入到NaClO溶液中:SO2+H2O+ClO- HClO+HSO3- HClO+HSO3- |
| D.含SO2溶液中,K+、Fe2+、SO32-、Br-可以大量共存 |
氰化氢(HCN)在电镀业有重要用途,其制备的化学方程式:C2H4+NH3 HCN+CH4+H2,下列说法正确的是
HCN+CH4+H2,下列说法正确的是
| A.CH4分子中所有原子都满足8电子稳定结构 |
| B.上述5种分子中原子均能共面 |
| C.HCN分子中σ键与π键之比为1:1 |
| D.转移0.2mol电子,生成2.24LH2 |
聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.1650 g。另一份溶液,先将Fe3+还原为Fe2+,再用0.0200 mol·L-1 K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液33.33 mL。该聚合硫酸铁样品中a∶b的比值为(已知:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O)。
| A.2∶1 | B.3∶1 | C.1∶1 | D.4∶5 |