高纯二氧化硅可用来制造光纤。某稻壳灰的成分为:
| 组分 |
SiO2 |
C |
Na2O |
K2O |
Al2O3 |
Fe2O3 |
| 质量分数 |
59.20 |
38.80 |
0.25 |
0.50 |
0.64 |
0.61 |
通过如下流程可由稻壳灰制备较纯净的二氧化硅。
请回答下列问题:
(1)根据氧化物的性质进行分类,稻壳灰中涉及的氧化物最多有 类。
(2)步骤①中涉及SiO2的离子反应方程式为 。
(3)滤渣A的成分有 (填化学式)
(4)步骤③反应的化学方程式为: ;
(5)实验室进行步骤③用到的仪器有坩埚钳、酒精灯、三脚架、 和 。
一种生产胺菊酯的重要原料,结构式为 ,可用下列路线合成。
,可用下列路线合成。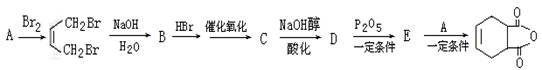
已知 :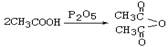 ,
, 。
。
(1)C的结构简式_________________,A的系统命名为_________________
(2)D中官能团名称________________,C→D反应类型________________
(3)写出C与足量的NaOH溶液共热反应的化学方程式_______________________
(4)写出既能发生水解反应,又能发生银镜反应的B的同分异构体的结构简式(写出一种即可)________
(5)下列说法正确的是______
| A.反应物A属于不饱和烃 |
| B.该产品的化学式为C8H10O3 |
| C.在B→C反应中,不能先催化氧化,再与HBr加成 |
| D.D的核磁共振氢谱有4个吸收峰 |
N、Cu、H、O、S、Mg是常见的六种元素:
(1)Mg位于元素周期表第___周期第____族;.N与O的基态原子核外未成对电子个数比为;Cu的基态原子电子排布式为___________
(2)用“>”或“<”填空:
碱性:Mg (OH)2 ____ Cu(OH)2第一电离能:O____ N
离子化合物熔点:MgS____MgO稳定性:H2S____ H2O
(3)Mg在空气中燃烧可微量生产氮化镁(Mg3N2),Mg3N2(S)溶于足量的稀硫酸可得到两种溶液呈酸性的盐,在25℃、101kPa下,已知该反应每消耗1mol H2SO4放热akJ,则该反应的热化学方程式为_________。
(4)工业上采取加热条件下用氨气还原氧化铜制取铜,同时得到两种无污染的气体(或蒸汽)。写出该反应的化学方程式,并标出电子转移的方向和数目_________________。
(一)在温度 和
和 下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
下,卤素X2(g)和H2反应生成HX的平衡常数如下表:
| 化学方程式 |
K(t1) |
K(t2) |
F2+H2 2HF 2HF |
1.8×1036 |
1.9×1032 |
Cl2+H2 2HCl 2HCl |
9.7×1012 |
4.2×1011 |
Br2+H2 2HBr 2HBr |
5.6×107 |
9.3×106 |
I2+H2 2HI 2HI |
43 |
34 |
(1)已知t2>t1,生成HX的反应是反应(填“吸热”或“放热”)。
(2)用电子式表示HCl的形成过程。
(3)共价键的极性随共用电子对偏移程度的增大而增强,HX共价键的极性由强到弱的顺序是(用化学式表示)。
(4)K的变化体现出X2化学性质的递变性,用原子结构解释原因是。
(二)下图表示一些晶体结构,它们分别是晶体干冰、金刚石、氯化铯、氯化钠某一种的某一部分。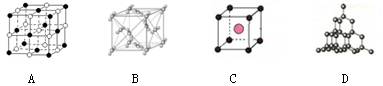
(5)代表金刚石的是(选填字母);晶体中碳原子与C—C键数目之比是。
(6)上述B、C、D三种物质熔点由高到低的排列顺序为(用字母表示)。
(7)金属镍及其化合物在合金材料以及催化剂等方面应用广泛,NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiOFeO(填“<,>或=”)。
(1)下列ΔH表示物质燃烧热的是;表示反应中和热ΔH="-" 57.3 kJ·mol-1的是。(填“ΔH1”、“ΔH2”和“ΔH3”等)
| A.C(s)+1/2O2(g) = CO(g)ΔH1 |
| B.2H2(g)+O2(g) = 2H2O(l)ΔH2 |
| C.C(s)+O2(g)= CO2(g)ΔH3 |
D. Ba(OH)2(aq)+ Ba(OH)2(aq)+ H2SO4(aq) = H2SO4(aq) =  BaSO4(s)+H2O(l)ΔH4 BaSO4(s)+H2O(l)ΔH4 |
E.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l)ΔH5
F.2NaOH(aq)+H2SO4(aq) = Na2SO4(aq)+2H2O(l)ΔH6
(2)在25℃、101kPa下,16.0g甲醇燃烧生成CO2和液态水时放热363.0kJ。则表示甲醇燃烧热的热化学方程式为。
(3)化学反应的能量变化(ΔH)与反应物和生成物的键能有关(键能可以简单理解为断开1mol化学键时所需吸收的能量),下表是部分化学键的键能数据:
| 化学键 |
P—P |
P—O |
O==O |
P==O |
| 键能kJ/mol |
a |
360 |
500 |
434 |

已知白磷(P4)的燃烧热为2378kJ/mol,白磷完全燃烧的产物(P4O10)的结构如上图所示,则上表中a=(保留到整数)。
研究NO2、SO2 等大气污染气体的处理具有重要意义。
(1)铜与浓硝酸反应生成NO2的化学反应方程式是。
(2)NO2可用水吸收,该反应的化学反应方程式是。
(3)工业上可将SO2通入浓的Fe2(SO4)3溶液中来治理污染得副产物绿矾和硫酸,写出该反应的离子方程式。
(4)利用反应6NO2 + 8NH3 7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是L。
7N2 + 12H2O也可处理NO2。当反应转移0.6mol电子时,则消耗的NH3在标准状况下的体积是L。
(5)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2SO3(g) ΔH1=" -" 196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
2NO2(g) ΔH2=" -" 113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的
SO3(g)+NO(g)的
ΔH=kJ·mol-1。
一定条件下,将NO2与SO2以物质的量之比1∶2置于恒容密闭容器中发生上述反应。
①下列能说明反应达到平衡状态的是()。
| A.体系压强保持不变 | B.SO3和NO的体积比保持不变 |
| C.混合气体颜色保持不变 | D.每消耗1 mol SO3的同时消耗1 mol NO2 |
②测得上述反应平衡时NO2与SO2物质的量之比为1∶11,该反应的平衡常数K =(保留1位小数)。