有机物键线式结构的特点是以线示键,每个折点和线端处表示有一个碳原子,并以氢补足四键,C、H不表示出来,其它原子或原子团要表示出来,例如:CH3CHOHCH3的键线式结构为 。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为
。CH3CH=CHCH3是石油裂解的产物之一,它的键线式结构可表示为 。
。
(1)CH3CH=CHCH3的名称为 ,其所含官能团的结构式为 ,与H2在一定条件下发生加成反应,其产物的同分异构体的键线式结构为 。
(2)完成下列反应方程式,产物用键线式表示: +Br2→ ,反应类型为 反应。
+Br2→ ,反应类型为 反应。
(3) 是一种加聚产物,则其单体的结构简式为 ,其链节为 。
是一种加聚产物,则其单体的结构简式为 ,其链节为 。
(4)写出与CH3CH=CHCH3含有相同官能团的同分异构体的结构简式 。(任写一种)
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银。
①(H3PO2)中,磷元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4︰1,则氧化产物为:(填化学式);依据所学关于电镀的原理,分析该电镀过程中可选用的电极材料为阳极:;阴极:。
③NaH2PO2是(填“正盐”还是“酸式盐”),其溶液显性(填“弱酸性”、“中性”、或者“弱碱性”),其溶液中离子浓度由大到小的顺序应为
(3)(H3PO2)也可以通过电解的方法制备。
工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):
①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是:。
A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.2H2(g)+O2(g)=2H2O(1)△H<0
C.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1)△H<0
(2)以H2SO4溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式为
(3)现将你设计的原电池通过导线与下图中电解池相连,
其中a为电解液,X和Y均为惰性电极,则:
①若a为CuSO4溶液,则电解时的化学反应方程式为。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体为672 mL(标准状况下)时,溶液的pH =(假设电解后溶液体积不变)。
大气含有的CO、氮氧化物、SO2、烟尘等污染是导致雾霾天气的原因之一,化学反应原理是减少和控制雾霾天气的理论依据。
(1)CO2经常用氢氧化钠来吸收,现有0.4molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中的溶质及物质的量为。
(2)CO可制做燃料电池,以KOH溶液作电解质,向两极分别充入CO和空气,工作过程中,负极反应方程式为:___________________。
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++ O2+ 4H+=4Fe3++ 2H2O,则另一反应的离子方程为;
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为。
(5)已知在常温常压下:①CH3OH(l)+O2(g)= CO(g)+2H2O(g) △H=" -359.8" kJ·mol-1
②2CO(g)+O2(g)=2CO2(g)△H=" -556.0" kJ·mol-1
③H2O(g)=H2O(l)△H=" -44.0" kJ·mol-1
写出体现甲醇燃烧热的热化学方程式。
常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如表所示:
| 实验编号 |
HA的物质的量浓度(mol·L-1) |
NaOH的物质的量浓度(mol·L-1) |
混合后溶 液的pH |
| 甲 |
0.1 |
0.1 |
pH=7 |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,判断HA是(填“强酸”或“弱酸”)
某同学欲利用甲组中的一元酸HA溶液滴定未知浓度的NaOH溶液,可选取作指示剂;在滴定过程中,下列哪些操作会使结果偏高的是
A.酸式滴定管未用标准酸HA润洗,直接装入标准酸HA
B.酸式滴定管滴定前有气泡,滴定后气泡消失
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
D.读取酸HA体积开始时仰视读数,滴定结束后俯视读数
E.锥形瓶用蒸馏水洗净后,再用待测NaOH溶液润洗
(2)根据乙组数据分析,乙组混合溶液中离子浓度c(A-)和c(Na+)的大小关系是
A.前者大 B.后者大C.两者相等D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
(4)分析丁组数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)=mol·L-1。
某同学取丁组试剂各100mL,充分反应后测得放出的热量为Q,写出表示中和热的热化学方程式
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O4和NH4NO3产品的流程图如下(Ce为铈元素):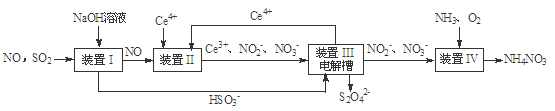
(1)装置Ⅰ中的主要离子方程式为。
(2)含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中。
向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因:。
(3)装置Ⅱ中,发生了两个氧化还原反应,产物分别为NO2-和NO3-,写出酸性条件下生成NO3-的反应的离子方程式。
(4)装置Ⅲ还可以使Ce4+再生,其原理如下图所示。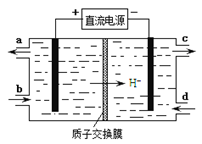
①生成Ce4+从电解槽的(填字母序号)口流出。
②写出阴极的反应式。
(5)已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2L。(用含a代数式表示)