乙醇分子中各种化学键如图所示。关于乙醇在下列反应中断键情况的说法中不正确的是
| A.与金属钠反应时键①断裂 |
| B.与乙酸发生酯化反应时键①断裂 |
| C.与浓硫酸共热到170 ℃时键③、④断裂 |
| D.在铜催化下与氧气反应时键①、③断裂 |
向Cu和Cu2O的混合物27.2g中加入某浓度的硝酸0.1L,固体物质完全反应,生成NO2、 N2O4、NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,溶液恰好呈中性,金属离子也已完全沉淀,沉淀质量为39.2g。以下所得结论不合理的是
| A.硝酸的物质的量浓度为12.0mol/L |
| B.产生的气体在标准状况下的体积为13.44L |
| C.Cu与Cu2O 的物质的量之比为2:1 |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
下表是元素周期表的一部分,请根据表中a~k对应元素,回答下列有关问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
a |
b |
||||||
| 3 |
c |
d |
e |
f |
g |
h |
||
| 4 |
J |
k |
(1)写出a的原子的最外层电子排布式,a的原子最外层有个未成对电子。
(1)在上述元素中的最高价氧化物对应的水化物中,最强酸的化学式是;最强碱与两性氢氧化物反应的化学方程式为:。
(1)写出上述元素中和Ar核外电子排布相同的离子半径由大到小的顺序:(用离子符号表示),上述两种元素能结合成XY型离子化合物,且每个阴、阳离子中均含10个电子,已知常温下该物质的水溶液显碱性,其原因是(用离子方程式表示)。
(1)下列能用作f和g元素非金属性强弱比较的判断依据的是()
A.单质熔点: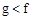
B.最高价氧化物对应水化物的酸性: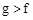
C.最高价氧化物对应水化物的溶解性: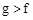
D.f不能与氢气反应,g能与氢气反应
标准状况下2.24LH2和Cl2组成的混合气体,经光照后缓缓通入100ml1mol/LNaOH溶液中充分反应,测得最终溶液中NaClO的浓度为0.1mol/L(假设溶液体积不变,且不考虑水解),则原混合气体中Cl2的体积分数为()
| A.55% | B.60% | C.65% | D.70% |
常温下pH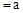 的CH3COOH稀溶液与pH
的CH3COOH稀溶液与pH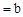 的NaOH稀溶液等体积混合,下列判断错误
的NaOH稀溶液等体积混合,下列判断错误
的是()
A.若混合后pH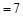 ,则 ,则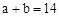 |
| B.反应过程中,CH3COOH的电离度增大 |
C.若混合后pH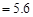 ,则c ,则c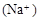 <c <c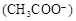 |
D.若混合后CH3COOH与NaOH恰好完全反应,则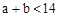 |
节日期间对大量盆栽鲜花施用了S-诱抗素制剂,以保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法正确的是()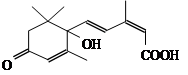
| A.其分子式为C15H20O4 |
| B.1mol该物质完全燃烧,消耗20mol氧气 |
| C.既能发生加聚反应,又能发生缩聚反应 |
| D.既能与FeCl3溶液发生显色反应,又能使酸性KMnO4溶液褪色 |