实验是学习化学的一个重要途径。
(1)根据下图回答问题。
①仪器a的名称是 。
②实验室用高锰酸钾制取氧气时,所选用的发生装置是 (填字母序号,下同),收集装置
是 或E。写出该反应的化学方程式 。
(2)实验室配制50g 5%的氯化钠溶液的操作示意图如图所示。其中玻璃棒的作用是 。该实验的正确操作顺序为 (填字母序号)。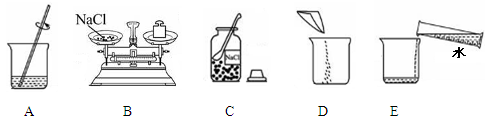
(3)实验室常用过氧化氢溶液与二氧化锰混合制取氧气.现将2.5g二氧化锰放入盛有100g过氧化氢溶液的锥形瓶中,反应完全结束后,共收集到1.6g气体.请完成下列问题:
①反应结束后,过滤,洗涤并烘干滤渣,称得滤渣的质量为 g.
②计算原过氧化氢溶液中溶质的质量分数.
探究燃烧条件的实验装置如图所示.观察到实验现象如图: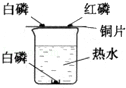
A.烧杯中白磷不燃烧;
B.铜片上白磷燃烧,产生大量白烟;
C.铜片上红磷不燃烧。
(1)由现象A和B得到燃烧的条件是;
(2)实验中发生反应的化学方程式为;
(3)实验中使用铜片,是利用了铜的性。
食醋是一种能增强食品酸味的调味剂,主要成分为醋酸(CH3COOH),与我们生活密切关联。请根据所学知识回答:
(1)食醋能作酸味的调味剂,是因为醋酸在水溶液中能解离出CH3COO﹣和(填离子符号)。
(2)与食醋一样,硫酸、柠檬酸等酸溶液都能使紫色石蕊溶液变色;都能与活泼金属反应生成气;都能与某些金属氧化物反应生成水;都能与碱发生中和反应。
(3)若浓硫酸不慎沾到皮肤或衣服上,应用冲洗后,再用涂上3%~5%碳酸氢钠溶液。
会用化学眼光看物质世界,是学习化学知识后应有的素质。结合下面材料填空。
材料一:一氧化碳是一种没有颜色、没有气味的气体,它能够燃烧,燃烧时放出大量的热,火焰呈蓝色。
(1)从化学物质类别看,CO属于(填“单质”或“化合物”)。
(2)从微观变化角度,“CO燃烧”的微观示意图如图所示。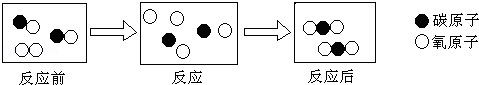
用化学符号表示图中反应后的粒子:。
(3)从物质用途看,CO有可燃性,可以作为。
材料二:饮用硬度较大的地下水【含一定量的Ca(HCO3)2、MgSO4和少量的FeCl3】会影响健康。
(1)可用来检验某地下水是不是硬水.
(2)新买的铝壶用来烧水时,内壁被水淹没处有黑色物质生成,底部则有白色物质生成。
①黑色物质是铁,是铝壶与硬水中含有的某种物质发生反应形成的,其化学反应方程式为:。
②白色物质是水垢【主要成分是CaCO3和Mg(OH)2】,可用盐酸除去,其中用盐酸除去Mg(OH)2的反应方程式为。
铁是生产生活中应用最广泛的一种金属。
(1)铁元素与地壳中含量最多的元素组成的化合物化学式为(写出一种即可)。高铁酸钠(Na2FeO4)是一种新型高效的净水剂,高铁酸钠中铁元素的化合价为价。
(2)常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性炭铁粉。请将下列脱氧中主要反应的化学方程式补充完整:4Fe(OH)2+O2+2=4Fe(OH)3。
(3)高温条件下一氧化碳能把铁从赤铁矿石(主要成分为Fe2O3)中还原出来,反应的化学方程式
是。
甲、乙两种固体物质的溶解度曲线如图所示,回答下列问题:
(1)由甲、乙两种物质的溶解度曲线可判断,溶解度受温度影响较大的是(选填“甲”或“乙”)。
(2)40℃时,乙的溶解度为g;40℃时,饱和溶液中乙的质量分数为(精确到0.1%);60℃时,把65g的甲加入50g水中,充分溶解,得到该温度下甲的水溶液是(填“饱和”或“不饱和”)溶液.
(3)从甲的饱和溶液中提取甲,应采用方法是(填“冷却结晶”或“蒸发溶剂”)。