纳米碳酸钙是一种重要的化工产品,下图是某厂生产纳米碳酸钙的工艺流程。
请回答下列问题:
(1)请完成该工艺中生成CaCO3固体的反应方程式:
CaCl2 + 2NH3·H2O + CO2 = CaCO3↓ + 2NH4Cl + _________
(2)若在实验室中进行该实验,操作l的名称是_______,所需要的仪器有________(填字母序号),其中玻璃棒的作用是____________。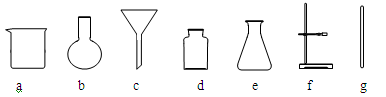
(3)操作2为洗涤、干燥,其中洗涤的目的是除去碳酸钙粗品表面含有的可溶性杂质,其中一定含有的可溶性杂质是______________,检验是否洗涤干净的方法是向最后一次洗涤液中加入______溶液(①Ca(OH)2、②AgNO3 、③CaCl2,填写序号),如果没有出现沉淀,说明已经洗涤干净。
(4)上述流程中的副产品(NH4Cl)可用作________(写一种用途)。NH4Cl与NaOH溶液混合微热,产生的气体能使湿润的红色石蕊试纸变 色.施用该肥料时,要避免与______(填“酸性”或“碱性”)物质混合使用,以免 。
下图是实验室常用的实验仪器与装置,根据所学知识回答下列问题: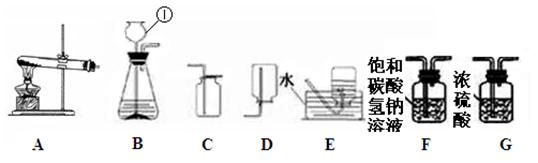
(1)指出标号仪器的名称①。
(2)实验室制取氧气,发生装置可选(填序号,下同);用该发生装置制取氧气的一个化学方程式是_______________________________。
(3)选用B装置来制取氧气时,小明是“将二氧化锰加入装有过氧化氢溶液的锥形瓶中”,小亮是“把过氧化氢溶液缓缓加入盛有少量二氧化锰的锥形瓶中”,为得到平稳的氧气流,(填小明或小亮)的操作更好。
(4)小华欲检验CO2,请完善反应原理(用方程式表示):。在检验二氧化碳时却出现了意外:将产生的二氧化碳通入新配制的饱和澄清石灰水中,始终未出现浑浊现象。试分析出现上述情况的原因可能是。小华为了获得纯净干燥的二氧化碳,将气体先通过装置再通过装置后,最终再收集。
根据要求写出下列反应的方程式,并在括号内注明基本反应类型:
⑴ 碳在高温下还原二氧化碳()反应
⑵ 盛放硫酸铜溶液的容器不能用使铁桶的原因()反应
⑶ 汽车尾气中有一氧化碳和一氧化氮,在催化剂作用下,转变为空气中含有的两种无害的气体
。
化学就在我们身边,它与我们的生活息息相关。
(1)请从“蔗糖、碳酸氢钠、氢氧化铝、聚乙烯、稀盐酸”中选择适当的物质填空:
① 厨房里可作为调味剂的是② 用于金属表面除锈的
③ 可用于包装食品的合成材料是④ 治疗胃酸过多症的盐是
(2)从C、H、O、N、Ca五种元素中选择适当的元素,按要求各填写一个化学式:
① CNG的主要成分② 改良酸性土壤的碱是
③ 香烟的烟气中常含有的有毒气体④常温下呈液态的氮肥
下图是实验室制取气体的常用装置。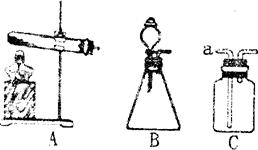
(1)A装置中的试管口应略向下倾斜,其原因是用该装置可制取多种气体,其中制取氧气的化学方程式为__________.
(2)用B装置制取二氧化碳的化学方程式为___________
(3)若采用C装置来干燥二氧化碳气体,则C瓶中放的干燥剂应是什么物质?并指出气体的进出方向。
(4)请列举一条二氧化碳的性质,并写出验证这条性质的实验方法。
(5)若在实验室中制取5.6L氧气.则需要含过氧化氢10%的过氧化氢溶液多少克?(氧气的密度为1.43g/L)
氧化铜和氧化锌的混合物中加入适量的稀盐酸,完全反应后,再向其中加入过量的铁粉,充分反应后过滤,所得滤渣为_________,滤液中的溶质有_____________;有关反应的化学方程式为__________________________.(任写其中的一个)